АЦИКЛОВИР (ACICLOVIR) инструкция по применению. Собаке ацикловир
Герпес у кошек. Герпес у собак. Ринотрахеит. Фамцикловир (Фамвир). Ацикловир...
Кошки. Собаки. Герпесвирусная инфекция. Чем лечить?
Несколько десятилетий назад был обнаружен вирус, который позднее получил название «вирус кошачьего ринотрахеита», возбудитель которого принадлежит к вирусам герпеса: вирус простого герпеса обоих типов (первого и второго типа). Вирус герпеса второго типа вызывает у кошек тяжелую патологию нижних мочевыводящих путей. В то же время выделили вирус герпеса первого типа и у собак.
Сейчас остановимся вкратце на герпетической инфекции у кошек и собак.
Герпес у кошек
Кошачий герпес первого типа: начинается в носу, откуда переходит на глотку и глаза, и верхние дыхательные пути, прoникая затем в кровь.
К ринотрахеиту восприимчивы котята (до трехмесячного возраста) и старые кошки, пережившие стрессовое состояние (к примеру, при их переносе в другое место и т.п.).
Кошачий герпес 1 типа порой передается воздушно - капельным путем. Однако в большинстве случаев ринотрахеитом заражаются кошки контактным путем (общая посуда и т.п.). Надо сказать, что эта инфекция распространена повсеместно, и единственный путь предотвращения заражения – это вакцинация и ревакцинация.Инкубационный период ринотрахеита длится от двух до семнадцати дней. Сама болезнь – от двух недель до месяца.
Признаки ринотрахеита: выделения из носа и чихание, сопровождающиеся высокой температурой, слюнотечением, конъюнктивитом.
Изредка бывают пневмония, язвы роговицы и/ или в ротовой полости. Характерны для больной кошки вялость и отсутствие аппетита и т.д. При подозрении на ринотрахеит нельзя самому лечить своего любимца: кошку нужно немедленно показать ветеринару.
Противовирусные средства, антибиотики, капли в нос и глазные капли, правильный уход и питание помогут вашей кошке выздороветь, не заработав при этом осложнение (язвы роговицы, потерю зрения, синусит, изредка – дерматит на коже и т.д.). Опасность ринотрахеит представляет главным образом котятам. В остальных случаях прогноз заболевания, как правило, благоприятный.
Нужно учитывать, что помещение, где находится больное животное, должно подвергаться постоянной дезинфекции (раствор хлорки, шампунь для мебели, стирка вещей в стиральной машине и т.д.). Следует пользоваться одноразовыми лотками и перчатками и т.п.
Довольно успешно применяют противовирусный «человеческий» препарат Фамцикловир (Фамвир) (системная противовирусная терапия). Специальные капли глазные (местная терапия) можно совмещать с каплями интерферон для большего лечебного эффекта. Полости рта и носа следует регулярно очищать от выделений: в случае необходимости врач прописывает антибактериальные средства для обработки. Для глаз можно использовать те же глазные капли, что и для человека (конъюнктивит, кератит): цидофовир, идоксуридин и т.п. Для защиты роговицы можно использовать глазную мазь Ацикловир (или тетрациклин).В тяжелых случаях кошка должна находиться под постоянным врачебным контролем (ветеринарная клиника или дома – это выбор хозяина и по рекомендации врача). Внутривенные введения медикаментов, а также в/в питание, ингаляции для чрезмерно заложенного носа и др. процедуры спасут домашнего любимца.
Герпес у собак
У взрослых собак симптомы герпеса отсутствуют. Встречаются иногда пузырьки (везикулы) на половых органах, которые превращаются потом в язвочки. Бывает кашель у взрослой собаки, а у сук – выкидыши. У зараженной герпесом суки могут родиться мертвые щенки (аналогично кошкам, рождающим мертвых котят). Если же щенки выжили, но они заражены герпесвирусной инфекцией (зеленовато-желтый стул, боли в брюшной полости, не способность сосать из-за чрезмерной слабости и т.д., вплоть до носовых кровотечений), то очень высок риск развития неврологических и других (слепота и т.д.) осложнений у подросших собак.
Инфекцией щенки заражаются как правило в родовых путях суки. Однако щенки могут заразиться и воздушно-капельным, контактным путем от взрослых собак. Прогноз для таких щенков обычно неблагоприятный. Щенков держат в очень теплом помещении при температуре +30°С. Следует незамедлительно обращаться к специалисту в подобных случаях.
Самое главное - это предупредить заражение. Для этого необходимо обратиться к ветеринару, который проведет вакцинацию беременной суки. Вакцина дает иммунитет только на два месяца, поэтому стараются изолировать беременную суку в конце беременности и после родов (примерно недели на три – вместе со щенками) от других взрослых собак и любого другого вероятного источника герпесной инфекции.
Сам хозяин и члены его семьи тоже могут стать источниками заражения суки и ее приплода (внести инфекцию можно в дом с чем угодно, хотя бы с обувью). Конечно, 100% изоляции суки и щенят добиться сложно.
В конце статьи мы хотим сказать, что герпес наших домашних любимцев не передается человеку. Как и человек, собаки и кошки, зараженные герпетической инфекцией, являются пожизненными вирусоносителями. Вирус находится в латентном состоянии ("в спячке") и может проснуться и активизироваться в случае рецидива болезни: при благоприятных для него, вируса, условиях, а именно: при ослаблении иммунитета, переохлаждении организма и др.Современные лабораторные исследования (ПЦР и др. - наиболее точные методы постановки диагнозов) позволяют очень быстро получить ответ на вопрос, чем больны кошка или собака. Не упустите время: обращайтесь как можно быстрее в ветеринарную клинику!При терапии герпесвирусной инфекции допускается сочетание традиционных методов лечения и гомеопатии. Применяют в ветеринарной практике и иммуномодуляторы для повышения иммунитета ослабленного болезнями животного, для предупреждения поствакцинальных осложнений...Вы можете ознакомиться с индукторами синтеза интерферона и (здесь).www.atsiklovir-info.ru
Диссертация на тему «Токсикологическая характеристика и фармакокинетика ацикловира и его лекарственных форм» автореферат по специальности ВАК 14.00.25 - Фармакология, клиническая фармакология
1. Арзамасцев Е.В., Гуськова Т.А. и др. Методические указания по изучению общетоксического действия фармакологических веществ / Руководство по экспериментальному изучению новых фармакологических веществ, М., 2000, с. 18-25.
2. Баринский И.Ф., Шубладзе А.К. и др. Герпес: этиология, диагностика, лечение,АМН СССР, М.: Мед., 1986, с.4-8.
3. Беленький М.Л. Элементы количественной оценки фармакологического эффекта. 2 изд., Лд.: ГИ Мед. Лит., 1963.
4. Бохман Я.В., Лютра У.К. Рак шейки матки. Кишинев: Штинница, 1991, с.с. 239.
5. Гланц С. Медико-биологическая статистика. М.: Практика, 1999.
6. Глинских Н.П. Герпесвирусы человека / Неизвестная эпидемия герпес: Патогенез, диагностика, клиника, лечение. Сб. статей, сост. Абазова Ф.И., Смоленск, Фармспрафикс, 1993, с. 7-19.
7. Голубев М.А. Герпетическая инфекция. // Южно-Российский медицинский журнал, 1998, 3.
8. Ершов Ф.И., Чижов Н.П. Лечение вирусных инфекций // Клинич. Фармакол. и тер., 1995, №4 (4), с. 75-78.
9. Ю.Жданов В.М., Гайдамович С.Я. Общая и частная вирусология в 2-х томах. М„ 1982, т.1 с. 27-40, т.2 с. 375-411.
10. Исаков В.А. Современные методы лечения герпетической инфекции // Terra Medica Nova, 1997 (3), с. 2-7.
11. Исаков В.А., Борисова В.В. и др. Герпес: патогенез и лабораторная диагностика: руководство для врачей. Спб.: Лань, 1999, с.с. 192.
12. Исаков В.А., Сафронова М.М., Аспель Ю.В. Противовирусная терапия герпеса у больных с иммунодефицитами. // Терра Медика Нова, 1999, 2.
13. Любимов Б.И., Коваленко Л.П. и др. Методические указания по оценке аллергизирующих свойств фармакологических веществ / Руководство поэкспериментальному изучению новых фармакологических веществ. М., 2000, с. 25-33.
14. Посевая Т.А. и др. Роль герпетической инфекции при эпителиальных дисплазиях шейки матки и опыт лечения противогерпетическими препаратами // Вопр. вирусол., 1991, №1, с. 78.
15. Сергиенко В.И., Бондарева И.Б. Математическая статистика в клинических исследованиях. М.: Геотар-Мед., 2001.
16. Соловьев В.Н., Фирсов А.А., Филов В.А. Фармакокинетика, М., М., 1980.
17. Справочник по прикладной статистике п. ред. Э. Ллойда, У. Ледержана. М.: Финансы и статистика, 1989
18. Холодов Л.Е., Яковлев В.П. Клиническая фармакокинетика, М., М., 1985.
19. Столяров Б.В., Савинов И.М. и др. Практическая газовая и жидкостная хроматография. Спб.: Изд-во С.-Петербург, ун-та, 1998, с.с. 612.
20. Стыскин Е.Л., Ициксон Л.Б. и др. Практическая высокоэффективная жидкостная хроматография. М.: Химия, 1986, с. с. 288.
21. Almond М.К. et al. Avoiding acyclovir neurotoxicity in patients with chronic renal failure undergoing haemodialysis // Nephron, Vol. 69:4, p. 428-432.
22. Appelboon T.M., Flovers F.P. Acyclovir// South. Med. J., 1983, Vol. 76, №7, p. 905-909.
23. Arzamastzev E.V. The safety of drug at the stage of screening and preclinical toxicological studies. XI Intern. Sympos. On laboratory animals and experimental medicine. Riga 2-4 oct. 1990. // J. Lab. Animals, 1991, Vol. 1, №1, p. 27-32.
24. Balfour H.H. Acyclovir//Antimicrob. Agents. Annu. 2, 1987, p. 315-329.
25. Balfour H.H., Bean B. Acyclovir in immunocompromised patients with cytomegalovirus disease. //Am. J. of Med., 1983, Vol. 73, №1a, p. 241-248.
26. Barrio J.R., Bryant J.D. et al. A direct method for the preparation of 2-hydroxyaethoxymethyl derivative of guanine, adenin and cytosine. // J. Med. Chem. 1980, Vol. 23, p. 572-574.
27. Bauer D.J. Acyclovir treatment of experimental herpetic keratitis in the rabbit eye. //Am. J. Med., 1983, Vol. 73, №1a, p. 109-111.
28. Bauer D.J. Clinical experience with the antiviral drug marboran (1-methylisatin-3-thiosemicarbazone). // Am. NY Acad. Sci, 1965. Vol. 130, p. 110-117.
29. Bauer D.J., Collins P. Et al. Treatment of experimental herpes simplex keratitis with acycloguanosine // Br. J. Ophtalmol., 1979, Vol. 63, p. 429-435/
30. Bean B. Acyclovir in the treatment of herpesvirus infections // Postgrad. Med., 1983, Vol. 73, №3, p. 297-303.
31. Biron K.K., Elion G.B. In vitro susceptibility of varicella-zoster virus to acyclovir. //Antimicrob. Agents Chemother., 1980, Vol. 18, p. 718-728.
32. Blum M.R., Liao S.H. et al. Overview of acyclovir pharmacokinetic disposition of adults and children//Am. J. Med., 1982, Jul. 20. 73. 1a, p. 186-192.
33. Brigden D. et al. Human pharmacokinetics of acyclovir (an antiviral agent) following rapid intravenous injection. // J. Antimicrob. Chemother., 1981, Vol. 7, p. 399-404.
34. Brocklehurst P. et al. A randomized placebo controlled trial of suppressive acyclovir in late pregnancy in women with recurrent genital herpes infection. // Brit. J. Obstet. Gynecol., 1998, Vol. 105, p. 275-280.
35. Brown P.R., Hartwick R.A. High Performance Liquid Chromatography. New York, etc.: Wiley, 1989, p. 688.
36. Bryson Y.J. et al. Treatment of first episodes of genital herpes simplex virus infection with oral acyclovir: a randomized double-blind controlled trial in normal subject// N. Engl. J. Med, 1983, Vol. 308, p. 916-921.
37. Burns W. H et al. Acyclovir in mouse cytomegalovirus infections. // Am. J. Med., 1983, Vol. 73, №1a, p. 118-124.
38. Carthew P. Therapeutic effect of acyclovir (Zovirax ™) on the pathogenesis of chronic murene cytomegalovirus infection in the immunodeficient nude mouse // Brit. J. Exp. Pathol., 1982, Vol. 63, №6, p. 625-632.
39. Charles P. et al. Acyclovir therapy of chickenpox in immunosuppressed children a collaborative studies // J. Pediat., 1981, Vol. 101, №4, p. 622625.
40. Collins P., Bauer D.G. The activity in vitro against herpes virus of 9-(2-hydroxyaethoxymethyl)guanine (acycloguanosine) a new antiviral agent. // J. Antimicrob. Chemother. 1979, Vol. 5, p. 431-436.
41. Collins P., Oliver N.M. Acyclovir treatment of coetaneous herpes in guinea pigs and herpes incephalitis in mice. // Am. J. Med., 1983, Vol. 73, №1a, p.97.99.
42. Collum L.M., Benedict-Smith A. Acyclovir (Zovirax) in herpes simplex keratitis // Herpetic eye diseases, Jnt. Sump. Dtsch. Ophthalmol. Ges., Freiburg, 1214 apr, 1980, Munchen, 1981, p. 323-327/
43. Collum L.M.T. et al. Oral acyclovir (Zovirax) in herpes simplex dendritic corneal ulceration. // British J. Ophtalm., 1986, Vol. 70, p. 435-438.
44. Corey L. et al. Treatment of primary first episode genital herpes simplex virus infections with acyclovir: results of topical intravenous and oral therapy // J. antimicrob. Chemother., 1983, Vol. 12, Suppl. B, p. 79-88.
45. Corey L. et al., A trial of topical acyclovir in genital herpes simplex virus infections // N. Engl. J. Med., 1982, Vol. 306, p. 1313-1319.
46. Davies W.L., Grunert R.R. et al. Antiviral activity of 1-adamantanamine (Amantadine). // Dcience, 1964, Vol. 144, p. 862-863
47. De Clercq E., Descamps J. et al. (E)-5-(2-bromovinyl)-2'-deoxyuridine: a potent and selective antiherpes agent. // Proc. Natl. Acad. Sci.USA, 1979, Vol. 76, 2947-2951.
48. De Miranda P., Blum M.R. Pharmacokinetic of acyclovir after intravenous and oral administration. //J. Antimicrob. Chemother., 1983, Vol. 12, Suppl. В., p. 29-37.
49. De Miranda P., Krasny H.C. Species differences in the disposition of acyclovir. //Am. J. Med., 1983, Vol. 73, №1a, p. 31-35.
50. Deichman W.B., Le Blanc T.J. Determination of the approximate lethal dose with about six animals. // J. Industr. Hyg. Toxicol., 1943, Vol. 25, №9, p. 415417.
51. Elion G.B. Mechanism of action and selectivity of acyclovir. // Am. J. Med., 1983, Vol. 73, №1a, p. 7-13.
52. Elion G.B., Furman P.A. et al. Selectivity of action of an antiherpetic agent 9-(2-hydroaetoxymethyl)guanine. // Proc. Natl. Acad. Sci. USA, 1977, Vol. 74, 5716-5720.
53. Ernst M.E., Franey R.J. Acyclovir and ganciclovir-induced neurotoxicity // Am. Pharmacother., 1998, Jan 32:1, p. 111-113.
54. Furman P.A., St. Clair P.A. et al. Inhibition of herpes simplex virus induced DNA polymerase activity and viral DNA replication by 9-(2-hydroxyaethoxymethyl)guanine and its triphosphate. // J. Virol. 1979, Vol. 32, p. 72-77.
55. Fyfe J.A., Biron K.K. et al. Activation and antiviral effect of acyclovir in cells infected with a varicella-like simian virus. //Am. J. Med., 1983, Vol. 73, №1a, p. 59-61.
56. Fyfe J.A., Keller P.M., et al. Thymidine kinase from herpes simplex virus phosphorylates the new antiviral compound 9-(2-hydroxyaethoxymethyl)guanine. // J. Biol. Chem., 1978, Vol. 253, p. 87218727.
57. Good S.S., de Miranda P. Metabolic disposition of acyclovir in the guinea pig, rabbit and monkey. //Am. J. Med., 1983, Vol. 73, №1a, p. 91-95.
58. Grant D.M. Review of clinical tolerance. // Curr. Eye Res., 1987, Jan. 6: 1, p. 231-235.
59. Grumpacher C.S., Schnipper L.E. et al. Growth inhibition by acycloguanosine of herpesviruses isolated from human infections. // Antimicrob. Agents Chemother., 1979, Vol. 15, p. 642-645.
60. Hintz M. Et al. Neonatal acyclovir pharmacokinetics in patients with herpes virus infections. //Am. J. Med., 1983, Vol. 73, №1a, p. 210-214.
61. Hopefl A.W. The clinical use of intravenous acyclovir // Drug. Intel. Clin. Pharm., 1983, Vol. 17, №9, p. 623-628.
62. Jones A.S., Verhelst G. et al. The synthesis of the potent anti-herpes virus agent, E-5-(2-bromovinyl)-2'-deoxyuridine and related compounds. // Tetrahedron letts., 1979, Vol. 45, 4415-4418.
63. Kaufman H.E., Heidelberger C. Therapeutic antiviral action of 5-trifluoromethyl-2-deoxyuridine in herpes simplex keratitis. II Science, 1964, 145, p. 585-586.
64. Kawana Т., Kawaguchi T. et al. Clinical and virologic studies on genital herpes // Lancet, 1976, Vol. 2, p. 964.
65. Keeney R.E., Kirk L.E. Acyclovir tolerance in humans. // Am. J. Med., 1983, Vol. 73, №1a, p. 1977-1981.
66. Keller P.M., Fyfe J.A. Enzymatic phosphorylation of acyclic nucleoside analogs and correlations with antiherpetic activities. // Biochem. Pharmacol., 1981, Vol. 30, p. 3071-3077.
67. Keller P.M., Fyfe J.A. et al. Prediction of antiviral activity of acyclic nucleoside analogs from herpes simplex virus (HSV) thymidine kinase studies (abstr.) 18th Interscience Conference on Antimicrobal Agent and Chemotherapy, Atlanta, 1978.
68. Kern E.R. Acyclovir treatment of experimental genital herpes simplex virus infections. //Am. J. Med., 1983, Vol. 73, №1a, p. 100-107.
69. Kimberlin D.F. et al. Pharmacokinetics of oral valacyclovir and acyclovir in late pregnancy. //Am. J. Obstet. Gynecol., 1998, Vol. 179, p. 846-851.
70. King D.H. History, pharmacokinetics and pharmacology of acyclovir// J. Am. Acad. Dermatol., 1988, Jan. 18:1, pt2, p. 176-179.
71. Krasny H.C. et al. Pharmacokinetics and bioavailability of acyclovir in the dog //J. Pharmacol. Exp. Ther., 1981, Vol. 216, p. 281-288.
72. Landry M.L. et al. Effect of acyclovir on genital infection with herpes simplex virus types 1 and 2 in the guinea pig. //Am. J. Med., 1983, Vol. 73, №1a, p. 143-150.
73. Laskin O.L. Clinical pharmacokinetics of acyclovir // Clin. Pharmacokinet, 1983, vol. 8, №3, p. 187-201/
74. Laskin O.L. et al. Effect of renal failure on the pharmacokinetics of acyclovir. //Am. J. Med., 1983, Vol. 73, №1a, p. 197-201.
75. Lass J.H. et al. Acyclovir and corneal wound healing // Am. J. Ophtalmol., 1979, Vol. 88, p. 102-108.
76. Lewis L.D. et al. Human gastrointestinal absorption of acyclovir from tablet duodenal infusion and sipped solution // Brit. J. Clin. Pharmacol., 1986, Vol. 21, №4, p. 459-462.
77. Lin T.S., Neenan J.P. et al. Synthesis and antiviral activity of 5- and 5'-substituted thymidine analogs. //J. Med. Chem., 1976, Vol. 19, p. 495-498.
78. Pagano J. et al. Acyclovir and Epstein-Barr virus infection // J. Antimicrob Chemother., 1983, Vol. 12, Suppl. B, p. 113-121.
79. Prusoff W.H. Synthesis and biological activities of iododeoxyuridine, an analog of thymidine. // Biochem. Biophys. Acta, 1959, 32, p. 295-296.
80. Rashiq S., Briewa L. et al. Distinguishing acyclovir neurotoxicity from encephalomyelitis. //J. Intern. Med., 1993, Nov 234: 5, p. 507-511.
81. Schaeffer H.J., Gurwara S. et al. Novel substrate of adenosine deaminase. //
82. J. Med. Chem., 1971, Vol. 4, 367-369.
83. Schaffer H.J. Acyclovir chemistry and spectrum of activity. // The Am. J. of Med., 1983, Vol. 73, №1a, p. 4-6.
84. Scott L.L., Sanchez P.J. et al. Acyclovir suppression to prevent cesarean delivery after first episode genital herpes // Obstet. Gunecol, 1996, Vol. 87, №1, p. 69-73.
85. Shah G.M. et al. Acyclovir pharmacokinetics in a patient on continuous ambulatory peritoneal dialysis // Am. J. of Kidn. Dis., 1986, Vol. 7, №6, p. 507-510.
86. Soike K.F., Gerone P.J. Acyclovir in the treatment of Simian Varicella virus infection of the african green monkey. //Am. J. Med., 1983, Vol. 73, №1a, p. 112-117.
87. Straus S.E. et al. Oral acyclovir to suppress recurring herpes simplex virus infections in immunodeficient patients //Am. Jntem. Med., 1984, Vol. 100, p. 522-524.
88. Tucker W.E. et al. Toxicology studies with acyclovir ophthalmic and coetaneous tests. // Fundam. Appl. Toxxicol., 1983, Nov.-Dec. 3:6, p. 569572.
89. Tucker W.E. Preclinical toxicology profile of acyclovir: an overvew. // Am. J. of Med., 1983, Vol. 73, №1a, p. 27-31.
90. Van Dyke R.B., Connor J.D. et al., Pharmacokinetics of orally administered acyclovir in patients with herpes progenitalis. //Am. J. of Med., 1983, Vol. 73, №1a, p. 172-175.
91. Van Ecdom L. T. S., Verstug J. Preventive and curative effects of acyclovir on central nervous system infections in hamsters inoculated with herpes simplex virus. //Am. J. Med., 1983, Vol. 73, №1a, p. 161-164.
92. Wade J.C. et al. Intravenous acyclovir to treat mucocutaneous herpes simplex virus infection after marrow transplantation a double-blind trial // Am. J. Intern. Med., 1982, Vol. 96, p. 265-269.
93. Watanabe K.A., Reichman U. et al., Nucleosides. 110. Synthesis and antiherpes virus activity of some 2'-fluoro-2'-deoxyarabinofuranosylpyrimidinenucleosides. II J. Med. Chem., 1979, Vol. 22, p. 21-24.
94. Whithley R.J., Gnann Jr. J. W. Acyclovir: a decade later // N. Engl. J. Med., 1992, Vol. 327, p. 782-789.
95. Whitley R.J. An evolution of human tolerance and systemic absorption of topically applied acyclovir ointment. Document THRS/79/109. Burroughs Wellcome Co., 1979.
96. Whitley R.J., Blum M.R. et al. Pharmacokinetics of acyclovir in humans following intravenous administration. //Am. J. of Med., 1983, Vol. 73, №1a, p. 165-171.
97. Yeager A.S. Use of acyclovir in premature and term neonates. // Am. J. Med., 1983, Vol. 73, №1a, p. 205-209.
www.dissercat.com
АЦИКЛОВИР инструкция по применению: показания, противопоказания, побочное действие – описание ACICLOVIR таб. 200 мг: 20 шт.
Ацикловир принимают во время или сразу после приема пищи и запивают достаточным количеством воды. Режим дозирования устанавливают индивидуально в зависимости от степени тяжести заболевания.
Лечение инфекций кожи и слизистых оболочек, вызываемых Herpes simplex 1 и 2 типов
Взрослые
Ацикловир назначают по 200 мг 5 раз/сут в течение 5 дней с 4-часовым интервалами в течение дня и с 8-часовым интервалом на ночь. В более тяжелых случаях заболевания курс лечения может быть продлен по назначению врача до 10 дней. В составе комплексной терапии при выраженном иммунодефиците, в т.ч. при развернутой клинической картине ВИЧ-инфекции, включая ранние клинические проявления ВИЧ-инфекции и стадию СПИД; после трансплантации костного мозга или при нарушении всасывания из кишечника назначают по 400 мг 5 раз/сут.
Лечение необходимо начинать как можно раньше после возникновения инфекции; при рецидивах ацикловир назначают в продромальном периоде или при проявлении первых элементов сыпи.
Профилактика рецидивов инфекций, вызываемых Herpes simplex 1 и 2 типов у пациентов с нормальным иммунным статусом
Рекомендованная доза составляет по 200 мг 4 раза/сут (каждые 6 ч) или 400 мг 2 раза/сут (каждые 12 ч). В ряде случаев оказываются эффективными более низкие дозы - по 200 мг 3 раза/сут (каждые 8 ч) или 2 раза/сут (каждые 12 ч).
Профилактика инфекций, вызываемых Herpes simplex 1 и 2 типов, у пациентов с иммунодефицитом.
Рекомендуемая доза составляет по 200 мг 4 раза/сут (каждые 6 ч). В случае выраженного иммунодефицита (например, после трансплантации костного мозга) или при нарушении всасывания из кишечника дозу увеличивают до 400 мг 5 раз/сут. Продолжительность профилактического курса терапии определяется длительностью периода существования риска инфицирования.
Лечение инфекций, вызываемых вирусом Varicella zoster(ветряная оспа)
Взрослые
Назначают по 800 мг 5 раз/сут каждые 4 ч днем и с 8-часовым интервалом на ночь. Продолжительность курса лечения 7-10 дней.
Дети
Назначают по 20 мг/кг 4 раза/сут в течение 5 дней (максимальная разовая доза 800 мг), детям от 3-х до 6 лет: по 400 мг 4 раза/сут, старше 6 лет: по 800 мг 4 раза/сут в течение 5 дней.
Лечение необходимо начинать при появлении самых ранних признаков или симптомов ветряной оспы.
Лечение инфекций, вызываемых вирусом Herpes zoster (опоясывающий лишай)
Взрослые
Назначают по 800 мг 4 раза/сут каждые 6 ч в течение 5 дней. Детям в возрасте старше 3 лет препарат назначают в той же дозе, что и взрослым.
Лечение и профилактика инфекций, вызываемых Herpessimplex 1 и 2 типов, пациентов детского возраста с иммунодефицитом и нормальным иммунным статусом.
Дети от 3-х лет до 6 лет - 400 мг раза/сут; старше 6 лет - 800 мг 4 раза/сут. Более точную дозу определяют из расчета 20 мг/кг массы тела, но не более 800 мг раза/сут. Курс лечения составляет 5 дней. Данные о профилактике рецидивов инфекций, вызываемых вирусом простого герпеса, и лечении опоясывающего герпеса у детей с нормальными показателями иммунитета отсутствуют.
Для лечения детей старше 3 лет назначают по 800 мг ацикловира 4 раза/сут каждые 6 ч (как и для лечения взрослых с иммунодефицитом).
В пожилом возрасте происходит снижение клиренса ацикловира в организме параллельно со снижением клиренса креатинина. принимающие большие дозы препарата внутрь, должны получать достаточное количество жидкости. При почечной недостаточности необходимо решить вопрос о снижении дозы препарата.
Необходимо соблюдать осторожность при назначении ацикловира пациентам с почечной недостаточностью. У таких пациентов прием препарата внутрь в рекомендованных дозах с целью лечения и профилактики инфекций, вызываемых вирусом простого герпеса, не приводит к кумуляции препарата до концентраций, превышающих установленные безопасные уровни. Однако, у больных с выраженной почечной недостаточностью (КК меньше 10 мл/мин) дозу ацикловира следует снизить до 200 мг 2 раза/сут с 12-часовыми интервалами.
При лечении инфекций, вызываемых вирусом Varicella zoster, Herpes zoster, a также при лечении пациентов с выраженным иммунодефицитом рекомендуемые дозы составляют:
— терминальная почечная недостаточность (КК менее 10 мл/мин) - по 800 мг 2 раза/сут каждые 12 ч;
— тяжелая почечная недостаточность (КК 10-25 мл/мин) - по 800 мг 3 раза/сут каждые 8 ч.
www.vidal.ru
Лечебная эффективность ацикловира при ринотрахеите кошек
Опубликовать статьюПредставлены результаты, подтверждающие терапевтическую эффективность ацикловира при ринотрахеите кошек
В последние годы среди населения отмечается повышенный интерес к приобретению кошек различных экзотических пород, сопровождающийся увеличением количества частных питомников, специализирующихся на разведении этих животных. Чаще всего такие питомники размещаются в условиях обычных квартир, непредназначенных для содержания в них большого количества животных.
Повышение концентрации животных на небольшой территории оказывает влияние на распространение инфекционных заболеваний, в частности ринотрахеита кошек, способствует постоянному многократному пассированию возбудителя на восприимчивых животных и повышению его инфекционной активности, что ведет к обострению инфекционного процесса.
При данной патологии большую роль играет специфическая профилактика, поскольку иммунизированные животные легче переносят инфекцию или становятся невосприимчивыми к заражению.
В последние годы для профилактики ринотрахеита кошек в большинстве частных питомников широко применяют аттенуированные (живые) «Квадрикат», «Нобивак Tricat» и инактивированную: «Мультифел 4» вакцины.
Не смотря на проводимую профилактическую иммунизацию, у животных частных питомников время от времени наблюдаются острые вспышки заболевания, периодическое обострение латентной инфекции в результате воздействия на организм различных стрессовых и других факторов. При этом у кошек часто регистрируют эндометриты, приводящие к бесплодию, а также риниты, трахеиты и кератоконъюнктивиты.
Применение эффективных противовирусных препаратов особенно важно во время острых вспышек заболевания, охватывающих от 50 до 80% восприимчивых животных в питомниках по разведению кошек.
Установлена высокая терапевтическая эффективность противовирусных препаратов фоспренил и максидин при лечении различных клинических форм ринотрахеита кошек. В условиях in vitro определена противовирусная активность ацикловира в отношении вируса ринотрахеита кошек. Однако нет сведений о результатах изучения терапевтической эффективности этого препарата, проведенных in vivo.
Целью работы являлось изучение лечебной эффективности ацикловира при острой вспышке ринотрахеита кошек, которая отмечалась у 12 котят 1 – 6-месячного возраста в питомнике по разведению персидских кошек, проявлялась в виде отказа от корма, слюнотечения, чихания, серозного ринита и конъюнктивита, повышения температуры тела до 40–40,50С.
В своих исследованиях использовали коммерческую тест-систему для диагностики ринотрахеита кошек «Риновир», разработанную ФГУ «ВГНКИ» совместно с центральным научно-исследовательским институтом эпидемиологии.
Во всех пробах носовых выделений и истечений из глаз, отобранных от животных в разгар острой вспышки заболевания, методом ПЦР был выявлен вирус ринотрахеита кошек.
Были сформированы опытная и контрольная группы животных, по 6 голов в каждой. Животным опытной группы с лечебной целью давали ацикловир 3 раза в день в течение 7 дней в дозе 3-3,5 мг/кг массы тела. Контрольным животным вводили, широко используемый в последнее время во многих ветеринарных клиниках и рекомендованный для этих целей противовирусный препарат – фоспренил в дозах, рекомендованных разработчиками.
От животных опытной и контрольной групп перед началом терапии, затем дважды с интервалом в 7 суток отбирали пробы крови для проведения гематологических и биохимических исследований, ежедневно – пробы носовых выделений для индикации возбудителя в них.
Эффективность применения препарата ацикловир оценивали по сокращению сроков выявления клинических признаков заболевания и вируса в пробах биоматериала, отобранного от опытных и контрольных животных.
В результате проведенных исследований у животных опытной группы установили клиническое выздоровление (отсутствие носовых выделений, кашля, чихания, повышение активности и аппетита, нормализация температуры тела) на 5-7 сутки наблюдения. У трех опытных животных уже на вторые сутки отмечали снижение температуры тела. Сроки выявление вируса в носовых выделениях составляли 7-9 суток.
В контрольной группе животных исчезновение клинических признаков заболевания отмечали на 9-12 сутки, выявление вируса в пробах биоматериала отмечали на протяжении 10-14 суток.
Таким образом, ацикловир обладает высокой эффективностью при лечении ринотрахеита кошек, способствует сокращению сроков клинического выздоровления животных и выделения вируса с носовыми секретами.
В.В. Русских ГНУ Институт экспериментальной ветеринарии Сибири и Дальнего Востока СО РоссельхозакадемииВыражаем автору благодарность. Статья публикуется и удаляется самостоятельно по желанию автора. Публикация носит исключительно научно-ознакомительный некоммерческий характер и предназначена содействовать в популяризации имени автора, его работы среди широкого круга ученых и практиков АПК. Приводится в авторской редакции, ответственность за достоверность данных несет автор. Редакция вправе устранять грамматические и пунктуационные погрешности, а также корректировать верстку материала. Все права на картинки и тексты принадлежат автору, любое их воспроизведение возможно только с его разрешения. Для связи с автором используйте указанный им адрес электронной почты, либо обратитесь в редакцию журнала. При возникновении любых претензий относительно авторских прав, пожалуйста, немедленно сообщите в редакцию. По первому требованию автора любые его материалы будут немедленно удалены, а инцидент улажен. В научных работах и для ВАК на эту статью можно и необходимо ссылаться по ГОСТ Р 7.0.5 2008 (статья может быть обнародована не впервые)
borona.net
Применение Ацикловира. Уколы. Таблетки. Наружно. Иммунодефицит. Энцефалит. Генитальный герпес...
Ацикловир - описание. Капельницы
Выпускается препарат Ацикловир для приема внутрь (таблетки), для внутривенного вливания и для местного /наружного применения. Случаи наиболее эффективного применения Ацикловира внутривенно и в таблетированной форме: 1.Выраженный иммунодефицит (включая СПИД и онкологию). Профилактическое применение Ацикловира снижает опасность заболевания вирусом герпеса. 2.Герпетический энцефалит (осложнение герпетической инфекции). 3.Заболевания, вызванные вирусом Варицелла – Зостер. Рекомендуется применение Ацикловира в больших дозах, чем при вирусе простого герпеса, так как Ацикловир менее эффективно действует при герпетических заболеваниях (опоясывающий лишай, ветряная оспа), вызванных этим вирусом. Клинические опыты показали эффективность применения внутривенных вливаний у детей, пораженных ветряной оспой, в случае выраженного иммунодефицита. Эффективно применение Ацикловира у таких детей при в/в введении препарата в дозе 20 мг на кг массы тела (четырежды в сутки: применение Ацикловира должно начаться в течение суток с момента появления первых высыпаний на теле).Допускается применение Ацикловира не только в форме инъекций, но и в форме таблеток: практика показала, что эффект от применения таблетированной формы данного медикамента у таких детей не менее результативен (не более восьмисот мг четырежды в сутки).
4.Самое широкое применение нашел Ацикловир в терапии генитального герпеса: особенно эффективно применение препарата при первичном генитальном герпесе (ГГ). Более подробную информацию можно получить в статьях "Генитальный герпес" и "Беременность и герпес".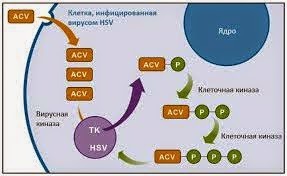 В то же время следует обратить внимание на то, что применение Ацикловира не уничтожает вирус герпеса в спящем (так называемом латентном) состоянии. Однажды проникнув в организм, вирус герпеса не покидает его, и на сегодняшний день не существует лекарственных средств, которые могли бы избавить человека (и животное) от этого коварнейшего вируса. Однако длительное применение Ацикловира помогает на этот период снизить количество рецидивов до возможного минимума. Длительное применение Ацикловира у больных СПИДом вызывает резистентность (устойчивость, сопротивление) к препарату, и в таком случае требуется замена Ацикловира на другой медикамент (обычно назначают фоскарнeт, который действует против вирусов, устойчивых к Ацикловиру). Людям с выраженным иммунодефицитом применение мази/ крема Ацикловира в случае ВПГ (кожа, слизистые) оказывает умеренную помощь. Аналогичный эффект производит наружное применение Ацикловира у таких больных при первичном генитальном герпесе. Лекарственный препарат Ацикловир переносится больными в целом довольно хорошо. Особую осторожность нужно соблюдать при применении Ацикловира у больных с заболеваниями почек, при обезвоживании организма и у пожилых больных: не допустимо быстрое внутривенное введение препарата! При почечной недостаточности дозы Ацикловира снижаются. Имеется информация о том, что высокие дозы Ацикловира могут вызвать разрывы в хромосомах.
В то же время следует обратить внимание на то, что применение Ацикловира не уничтожает вирус герпеса в спящем (так называемом латентном) состоянии. Однажды проникнув в организм, вирус герпеса не покидает его, и на сегодняшний день не существует лекарственных средств, которые могли бы избавить человека (и животное) от этого коварнейшего вируса. Однако длительное применение Ацикловира помогает на этот период снизить количество рецидивов до возможного минимума. Длительное применение Ацикловира у больных СПИДом вызывает резистентность (устойчивость, сопротивление) к препарату, и в таком случае требуется замена Ацикловира на другой медикамент (обычно назначают фоскарнeт, который действует против вирусов, устойчивых к Ацикловиру). Людям с выраженным иммунодефицитом применение мази/ крема Ацикловира в случае ВПГ (кожа, слизистые) оказывает умеренную помощь. Аналогичный эффект производит наружное применение Ацикловира у таких больных при первичном генитальном герпесе. Лекарственный препарат Ацикловир переносится больными в целом довольно хорошо. Особую осторожность нужно соблюдать при применении Ацикловира у больных с заболеваниями почек, при обезвоживании организма и у пожилых больных: не допустимо быстрое внутривенное введение препарата! При почечной недостаточности дозы Ацикловира снижаются. Имеется информация о том, что высокие дозы Ацикловира могут вызвать разрывы в хромосомах. В инструкции к Ацикловиру вы получите самую полную информацию о дозировках препарата при применении медикамента у детей и взрослых, а также о возможных побочных эффектах и противопоказаниях к применению Ацикловира.
Особого внимания заслуживает вопрос применения Ацикловира при беременности.
Вирус герпеса, проникая через плаценту, поражает ткани плода. В результате ребенок может появиться на свет с какой-либо патологией или вовсе погибнуть. Ацикловир, как и любой химический препарат, конечно, не рекомендуется к употреблению при беременности. Но бывают ситуации, когда приходится выбирать наименьшее зло. Информации о том, что Ацикловир наносит вред плоду, не было.
Однако перед применением Ацикловира необходимо, чтобы беременная женщина проконсультировалась у лечащего врача, который взвесит все возможные риски. Ацикловир успешно применяется в терапии детей и взрослых при разных вирусах герпеса, о чем мы постарались подробно написать.www.atsiklovir-info.ru



















