


Применяемая анестезия в ветеринарной хирургии может быть двух видов: ингаляционная и неингаляционная. Последняя находит своё широкое применение при оперативных вмешательствах любой сложности. Можно ли назначать Пропофол кошке в качестве анестетика?
Пропофол применяется в качестве гипнотического вещества.
Какие плюсы имеет лечение кошек Пропофолом:
© shutterstock
Давать Пропофол коту, как единственный анестетик, возможно только при непродолжительных вмешательствах. Например, чистке зубов животного, при осмотре полости рта и удалении чужеродных предметов из глотки.
При проведении длительных оперативных вмешательств, например, кастрации, Пропофол назначается в комбинации с различными анальгетиками.
Этот препарат не растворяется в воде, это белая маслянистая эмульсия.
Механизм воздействия не в обезболивании при оперативном вмешательстве, а в увеличении болевого порога. Он не накапливается в организме, соединяясь в крови с белками плазмы, распадается на составляющие в клетках печени и выводится через почки. Животное быстро просыпается после использования Пропофола.
В отличие от других животных, у кошек некоторые стадии метаболизма замедлены, из-за этого происходит медленный распад лекарственных препаратов, и они дольше выводятся из организма кошки.
На практике это приводит к увеличению концентрации веществ и их токсичному воздействию на кошку.
Пропофол относится к фенольным соединениям. Для их распада и вывода необходимы глюкурониды, которых не хватает у кошки. Поэтому животное медленнее просыпается после введения препарата.

© shutterstock
Дозировка пропофола коту не должна превышать 6÷8 мк/ кг при режиме одного анестезирующего компонента; если применяется вместе с анальгетиками — 4÷6 мк/кг.
Операции при указанной дозировке проходят без нарушения дыхания у кошек.
Анестофол – это лекарственный препарат, с активным веществом Пропофол. Из-за входящего в состав ледокоина, сводятся к минимуму болевые ощущения.
Пропофол обеспечивает быструю анестезию животного.
Назначают дозу Пропофола кошкам в зависимости от времени, необходимого для проведения процедуры обезболивания, и веса животного:
Для усыпления, щадящей эвтаназии, дозировка Пропофола коту составляет от 10 мг до 20 мг на кг веса животного.
Не рекомендуется перед наркозом кормить животное в течение суток. Препарат имеет свойство выводиться вместе с молоком, детёнышей прикладывают в матери не ранее, чем через несколько часов после анестезии.

© shutterstock
Изредка проявляется падение давления и синдром апноэ. Иногда наблюдается рвота и нервное возбуждение.
Ветофол — ещё один из препаратов для неингаляционного наркоза. Имея в своём составе Пропофол как действующее вещество, обеспечивает быстрое засыпание животного в течение одной минуты.
Ветеринарные врачи применяют Ветофол для кратковременного наркоза для кошек и собак, когда необходимо быстро вывести животное из гипнотического состояния.
Дозы Ветофола для кошек:
Могут наблюдаться рвота, кратковременное перехватывание дыхания, брадикардия.
При передозировке могут возникнуть осложнения с дыхательной системой, что потребует искусственную вентиляцию лёгких.
Современное анестезирующее средство, которое пришло на смену, во многих клиниках запрещённому, препарату Кетамин.
В своём составе два активных вещества. Каждое из них усиливает действие препарата. Хорошо переносится при применении мелкими животными. Не влияет на сосудистую систему и дыхательную, что объясняет его применение в большинстве оперативных вмешательств:
Анестезирующий эффект наступает после 1÷7 минут; более глубокий наркоз через 20÷60 минут. Действие Золетила прекращается от 1 часа до 5,5 часов. У детёнышей и старых животных период увеличивается.

© shutterstock
Если не требуется долгого анестезирующего эффекта, доза составляет 10мк/ кг; при более глубоком наркозе – 15мк/ кг.
Плацента пропускает препарат, поэтому возможно угнетение плода. С осторожностью применяют при почечных патологиях.
koshkamurka.ru
ФАРМАКОДИНАМИЧЕСКИЕ ЭФФЕКТЫ ПРОПОФОЛА ПРИ ИСПОЛЬЗОВАНИИ У СОБАК И КОШЕК
Е.А. Корнюшенков, А.И. ГимельфарбКлиника экспериментальной терапии НИИ клинической онкологии РОНЦ им. Н.Н. Блохина РАМН, Ветеринарная клиника «Биоконтроль».
«Институт развития ветеринарной интенсивной терапии, анестезиологии и реаниматологии -ВИТАР» МГАВМиБ им. КМ. Скрябина. Ключевые слова: анестезия, пропофол, седация
Сокращения: АД - артериальное давление; ДД/мин - дыхательные движения в минуту; ОА - общая анестезия; Уд/Мин - удары в минуту, ЧДД - частота дыхательных движений, ЧСС - частота сердечных сокращений, SpO2 - сатурация кислорода в гемоглобине, ИВЛ - искусственная вентиляция легких
Введение
Общая характеристика пропофола. Пропофол - внутривенный анестетик короткого действия, используемый как для индукции, так и для поддержания общей анестезии (ОА). Относится к фенолам и представляет собой 2,6-диизопропилфенол. Пропофол не растворим в воде, выпускается в виде 1%-й водно-масляной эмульсии белого цвета, рН нейтральный.
Препарат обеспечивает быструю индукцию в анестезию (60-90 сек.), которая, как правило, не сопровождается выраженной стадией возбуждения. Продолжительность анестезии после однократного . болюсного введения составляет в = среднем 5-10 мин. В более низких дозах пропофол вызывает седацию. Препарат не обладает анальгетическими свойствами, а повышает порог болевой чувствительности (т.е., уменьшает восприятие боли). Механизм действия пропофола до конца не изучен, однако доказано ингибирование ГАМК-медиаторной трансмиссии. Пропофол не обл а да ет кумул яти в н ы м и свойствами, поэтому пробуждение даже после длительной инфузии препарата наступает очень быстро как у человека, так и у животных большинства видов. При поступлении в организм пропофол в значительной степени (до 98%) связывается с белками плазмы крови. Метаболизируется в печени и вне ее. Метаболиты выделяются в основном почками. Короткая продолжительность клинического действия пропофола обусловлена как его перераспределением, так и быстрым метаболическим клиренсом. Концентрация препарата в плазме после струйного введения быстро снижается в основном за счет перераспределения пропофола из мозга и других хорошо васкуляризованных тканей в органы с менее интенсивным кровоснабжением.
Несмотря на то, что период полувыведения составляет (Т1/2=40-50 мин.), пробуждение наступает быстро даже после продолжительной инфузии пропофола. Причина подобного противоречий заключается в большом объеме
распределения пропофола в равновесном состоянии: он интенсивно перераспределяется в мышцы, жир и другие плохо васкуляризованные ткани.
Ожирение, умеренная дисфункция печени и почек не оказывает значительного влияния на продолжительность действия пропофола, несмотря на кумуляцию его метаболитов. Это дает основание предполагать, что метаболиты пропофола не обладают клинически значимым эффектом. Если скорость введения пропофола тщательно регулируется в зависимости от наблюдаемого эффекта, то снижается частота побочныхэффектов (например, артериальной гипотонии) и ускоряется пробуждение после анестезии.
Методика, называемая тотальной внутривенной анестезией (ТТВА, Total ntravenous anesthetics - TIVA) получила свое широкое распространение именно при применении пропофола. В настоящее время этот метод является реальной альтернативой ингаляционной (газовой) анестезии. Так, при сравнении управляемости различных анестетиков (LSmith, 1996, США), пропофол занял второе место (после дезфлюрана) по скорости пробуждения больных после наркоза, опередив изофлюран и севофлюран. Также важным аспектом использования пропофола является его противорвотный (антиэметический) эффект. N.R. Fahmu (1996, США)сообщает, что при использовании методикТг7А, включающих пропофол, синдром послеоперационной тошноты и рвоты отсутствовал, что весьма актуально, если животное было кормлено.
Особенности метаболизма кошек. Большинство липофильных веществ (за исключением ингаляционных анестетиков) подвергается в организме биотрансформации. Важнейшая роль в биотрансформации лекарственных веществ принадлежит микросомальным ферментам печени, благодаря которым липофильные соединения превращаются в гидрофильные и уже после этого экскретируются (как правило, с мочой). Если вещество не подвергается метаболизму, оно может накапливаться и вызывать токсические эффекты.
Печеночный метаболизм большинства препаратов состоит из двух фаз метаболической трансформации (первая) и конъюгации (вторая). В первую фазу за счет окисления, восстановления и гидролиза, вещества становятся более гидрофильными. Во вторую фазу к веществу или его метаболитам присоединяется ряд эндогенных веществ, таких как глюкуронид, глутатион, сульфаты, ацетил и др. Наиболее частой химической реакцией фазы конъюгации является глюкуронизация, которая катализируется ферментами, принадлежащими к семейству глюкуронилтрансфераз.
Было установлено, что у кошек значительно снижена активность некоторых глюкуронилтрансфераз, чем и объясняются особенности действия многих лекарственных средств на этот вид животных. В то время как у большинства животных фармакопрепараты быстро экскретируются из организма в виде конъюгатов глюкуроновой кислоты. У кошек клиренс понижен, а период полувыведения препаратов увеличен. Концентрация таких веществ у кошек повышается быстрее, и токсические эффекты более выражены (особенно ярко у этого вида животных проявляется токсичность ацетаминофена или парацетамола).
Однако, не все экзогенные вещества, метаболизм которых сопряжен с глюкуронизацией, токсичны для кошек. Во-первых, это зависит от того, какая именно глюкуронил-трансфераза требуется для метаболизма того или иного вещества и от выраженности дефицита данного фермента; во-вторых, от широты фармакологического действия вещества; в-третьих, от наличия альтернативных путей метаболизма. У кошек довольно хорошо развит путь конъюгации с сульфатами, который может компенсировать недостаточность глюкуронизации,
Пропофол - фенольное соединение и метаболизируется, главным образом, в печени с образованием глюкуронидов и сульфатных конъюгатов. Дефицитом глюкуронизации, необходимой для метаболизма фенольных соединений, и объясняется феномен более длительного пробуждения, отмеченный многими исследователями после длительного введения пропофола кошкам.
Анемия с образованием телец Хайнца (Heinz body formation anaemia). Тельца Хайнца представляют собой скопления денатурированного, преципитированного гемоглобина в эритроцитах. Их образование связано с окислительным повреждением эритроцитов под воздействием активных метаболитов кислорода (02, Н202, ОН-), а также с некоторыми другими механизмами. Окислительное повреждение способствует также переходу гемоглобина в метгемоглобин, который не способен присоединять кислород. В результате описанных процессов способность эритроцитов переносить кислород снижается.
У кошек тельца Хайнца обнаруживаются чаще, чем у животных других видов, что связано с более высокой интенсивностью их образования и более медленным удалением. Гемоглобин кошек содержит до 20 S-H-групп, в то время как у других видов животных и у человека их содержание не превышает 4. Повышенное содержание сульфгидрильных групп делает гемоглобин кошек более подверженным окислительному повреждению. Еще одним фактором, способствующим быстрому образованию телец Хайнца, считается легкий переход гемоглобина кошек из состояния тетрамера в состояние димера. Замедленное удаление из кровотока эритроцитов, содержащих тельца Хайнца, объясняется особенностями строения селезенки кошек. У здоровых кошек количество эритроцитов, содержащих тельца Хайнца, достигает 1-2%, хотя и при уровне в 10% кошки могут выглядеть клинически здоровыми.
Таблица 1. Распределение групп животных по характеру оперативного вмешательства у собак

К окислительным токсинам, вызывающим образование телец Хайнца у кошек, относятся метиленовый синий, ацетаминофен, фенацетин, пропилен-гликоль и др. Пропофол тоже является таким окислителям. Повреждение эритроцитов под действие** некоторых перечисленных препаратов объясняется не только особенностями строения гемоглобина кошек, но также более медленным метаболизмом этих веществ. Повышение количества телец Хайнца отмечено при некоторых системных заболеваниях, таких, как жировая дистрофия печени, сахарный диабет, гипертиреоидизм и лимфома. Поскольку у кошек метаболизм пропофола в связи с дефицитом глюкуронизации замедлен, время воздействия препарата на эритроциты продлевается, что увеличивает возможность их окислительного повреждения.
Материалы и методы
На базе Клиники экспериментальной терапии НИИ клинической онкологии РОНЦ имени Н.Н. Блохина РАМН совместно с ветеринарной клиникой «Биоконтроль» были апробированы схемы общей анестезии на основе препарата пропофол. Исследование проводилось на 41-й собаке и 35-ти кошках, проходивших плановое хирургическое лечение в ветеринарной клинике «Биоконтроль». Возраст собак составлял от 6-ти месяцев до 19-ти лет. Возраст кошек составлял от 4-х до 12-ти лет.
За основу тотальной внутривенной анестезии был взят препарат пропофол. Мониторинг осуществлялся с помощью кардиомонитора Sensitec 1200. Исследовались следующие показатели гемодинамики: ЧСС, ЭКГ, ЧДД, НАД, SpO2, Т. Мы регистрировали следующие этапы временного интервала: во время вводной индукции, через 5 мин. после индукции, через 30 мин. после индукции и через 60 мин. после индукции.
Все данные о мониторинге регистрировались в протоколе анестезиологического отделения ветеринарной клиники «Биоконтроль». Степень анестезиологического риска у оперируемых больных соответствовала 2-4 классу по классификации ASA.
Все животные были распределены на пять групп:
1-я группа(п=20): собаки в качестве индукции получали препараты пропофол в дозе 6-8 мг/кг МТ;кетамин 2,5 мг/кг МТ и ксилазин 1,25 мг/кг МТ. Далее, пропофол вводился в дозе 10 мг/кг/ МТ/час; кетамин 3,5 мг/кг/ МТ/час и ксилазин 1,5 мг/кг/ МТ/час. В качестве премедикации использовали атропин 0,025 мг/кг МТ; амоксицилин 12,5 мг/кг МТ п/к; тавегил 1,0 мл/10 кг МТ в/м.
2-я группа(п=13): собаки в качестве индукции получали пропофол в дозе 6-8 мг/кг МТ и фентанил в дозе 5 мкг/кг МТ. Далее, пропофол в дозе 12 мкг/кг/ МТ/час и фентанил 10 мкг/кг/ МТ/час. В качестве премедикации использовали атропин 0,025 мг/кг МТ; амоксицилин 12,5 мг/кг МТ п/к; тавегил 1,0 мл/10 кг МТ в/м.
3-я группа(п=8}: собаки в качестве индукции получали препарат пропофол в дозе 6-8 мг/кг МТ и золетил в дозе 4 мг/кг МТ. Далее, пропофол в дозе 12 мг/кг/ МТ/час и золетил в дозе 4 мг/кг МТ/час. В качестве премедикации использовали атропин 0,025 мг/кг МТ; амоксицилин 12,5 мг/кг МТ п/к; тавегил 1,0 мл/10 кг МТ в/м.
Вводную индукцию осуществляли болюсным введением препаратов, в дальнейшем индукцию проводили, используя одноканальные или двухканальные шприцевые дозаторы фирмы Sensitec.
Учитывая универсальность в применении пропофола, мы использовали его у пациентов, которым выполнялись операции разного профиля. В таблице 1 приведены данные о характере оперативного вмешательства у собак.
4-я группа: кошки (п=2О), которым были назначены непродолжительные лечебные процедуры (лучевая терапия) под ОА препаратом пропофол. Продолжительность анестезии составляла 10 мин. Оценивали такие параметры, как наличие или отсутствие возбуждения (опистотонуса) при вводной анестезии, ЧСС, SpO2 (с помощью пульсоксиметра фирмы Dixion), время и характер пробуждения животных. В качестве премедикации использовали атропин 0,025 мг/кг МТ в/в и тавегил 0,3 мл/животное в/в, разбавленный физиологическим растворам в пропорции 1:5. Индукционная доза 6-8 мг/кг МТ препарата пропофола болюсно.
В 5-ю группу(п=15) входили животные, которым было назначено плановое хирургическое вмешательство в объеме унилатеральной мастэктомии. Премедикация: атропин 0,05 мг/кг МТ п/к; амоксицилин 12,5 мг/кг МТ п/к; тавегил 0,3 мл/животное в/м; буторфанол 0,4 мг/кг МТ в/м. В качестве компонентов ОА пациентам применяли пропофол в дозе 4-6 мг/кг МТ и золетил 2 мг/кг МТ. Оценивали такие критерии, как наличие или отсутствие возбуждения у животного при индукции, АД, ЧСС, ЧДД, SpO2 (используя кардиомонитор фирмы Mindrey).

Животным всех групп с целью профилактики гиповолемии проводили инфузионную терапию раствором Рингера со скоростью 10 мл/кг МТ/час.
Результаты исследования у собак
При вводной индукции пропофолом мы наблюдали у 3-х собак (две - кане корсо, одна - английский бульдог белого окраса) гиперемию слизистых оболочек ротовой полости и глаз, а также гиперемию кожи в области ушей и мошонки, без признаков зуда.
У 2-х собак при вводной анестезии пропофолом наблюдался опистотонус и «плавательные» движения конечностями.
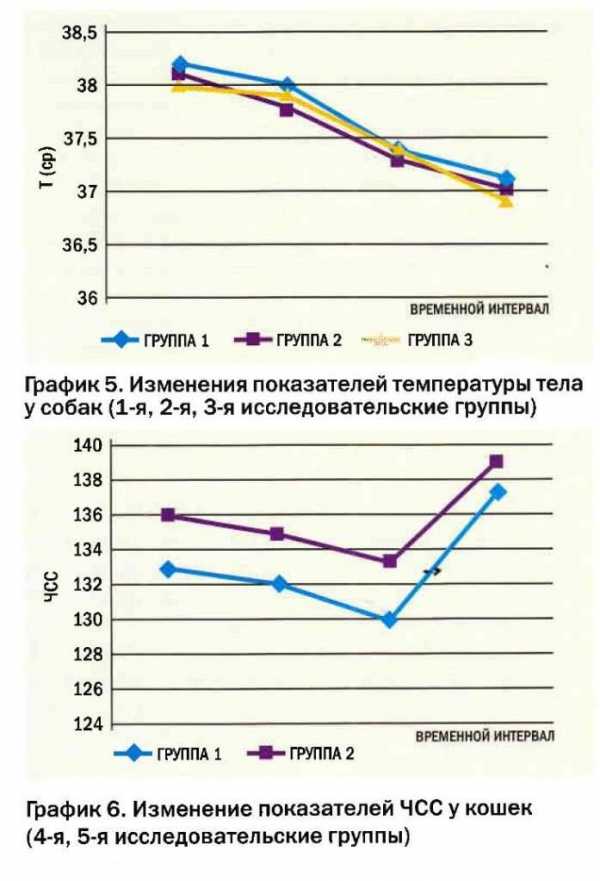
У собак всех групп мы наблюдали незначительные изменения со стороны частоты сердечных сокращений (ЧСС). В 1-й и 2-й группе мы наблюдали снижение ЧСС (график 1). У двух животных 1-й группы и одного животного 3-й группы наблюдалось снижение ЧСС ниже 50 уд/мин, после чего им применяли холи политические препараты (атропин 0,05 мг/кг в/в), что стабилизировало показатели гемодинамики. У остальных пациентов 3-й группы наблюдался незначительный подъем ЧСС после вводной индукции (график 1). Однако к моменту середины оперативного лечения ЧСС имела тенденцию к снижению.
При исследовании изменений АД мы наблюдали снижение АД походу операции у собак 1-й группы (график 2). У трех собак 1-й группы наблюдалось снижение АД ср. ниже 70 мм рт. ст., которое не стабилизировалось на фоне инфузионной терапии. Данным животным применяли вазоконстрикторы (допмин: 4 мкг/кг/ МТ/мин), что позволило стабилизировать показатели гемодинамики.
У собак 2-й группы наблюдалась тенденция к снижению АД после проведенной вводной индукции (график 2). У одного животного потребовалась стимуляция допмином. В дальнейшем мы наблюдали тенденцию к увеличению показателей артериального давления.
У животных 3-й группы мы наблюдали незначительное повышение АД ближе к концу оперативного лечения (график 2).
Снижение показателей сатурации относительно нормы (96-98%) наблюдалось у всех групп собак при вводной индукции (график 3). Наиболее низкой сатурация наблюдалась у пациентов 2-й группы (92,8%). Однако в дальнейшем показатели сатурации составляли нормальные значения во всех исследуемых группах.
Тенденция к снижению ЧДД наблюдалось у всех исследуемых групп (график 4}. Тенденция к ослаблению спонтанного дыхания наблюдалась у четырех (14,2%) животных 1-й группы, у восьми (66,6%) животных 2-й группы и шести (75%) животных 3-й группы. Им проводилась респираторная поддержка аппаратом ИБЛ Graph в режиме PCV , f = 10 - 15 Peep 0 - 5 см. вод. ст.
Уменьшение температуры тела наблюдалось у всех групп животных (график 5). Снижение температуры тела ниже 35,0 наблюдалось у одного животного 1-й группы и одного 2-й группы. Используя подогреваемые подстилки, и вводя теплые растворы, данные изменения гемодинамики были нивелированы.
Восстановление сознания (забор языка в ротовую полость, двигательная активность, обострение внимания при произнесении клички животного) наблюдалось быстрее у пациентов 2-й группы. В среднем, время пробуждения составило 35-40 мин. после операции продолжительностью 60 мин. В группах, где использовались диссоциативные анестетики (кетамин, золетил), это время продлевалось на 20-30 мин. и составляло от 50 до 70 мин. после операции продолжительностью 60 мин.
У трех животных 3-й группы наблюдалось психомоторное возбуждение, проявляющееся лаем и галлюцинациями («ловлей мух») в послеоперационном периоде.
Результаты исследования у кошек
При вводной анестезии препаратом пропофол мы не наблюдали признаков возбуждения или опистотнуса у исследуемых животных 4-й и 5-й групп. У четырех животных (по две кошки из обеих групп) мы наблюдали признаки опистотонуса после анестезии, которые не сопровождались другими неврологическими расстройствами (судороги, атаксия) и самопроизвольно нивелировались через 5-10 мин.
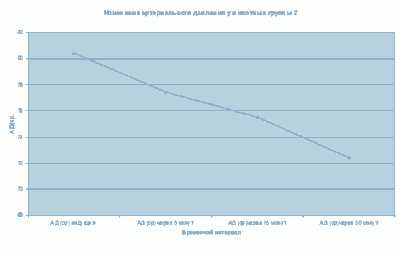
Изменения со стороны сердечно-сосудистой системы регистрировались в 4-х из 5-ти исследовательских групп. В 4-й группе мы наблюдали плавное снижение ЧСС (до 130 уд/мин) по ходу анестезии. В дальнейшем, на 10-й мин ЧСС повысилась (до 135 уд/мин), что соответствовало фазе пробуждения животного и являлось физиологической нормой. В 5-й группе на всем протяжении анестезии мы наблюдали снижение ЧСС (до 122 уд/мин), что являлось физиологической нормой и не требовало фармакокоррекции (график 6). Дополнительным методом контроля сердечно-сосудистой системы у животных 5-й исследовательской группы было измерение АД (график 8). Мы наблюдали тенденцию к снижению АД (среднее значение в группе до 72 мм рт. ст.), что соответствовало норме и не требовало дополнительного введения вазоконстрикторов.
Изменения со стороны дыхательной системы регистрировали поданным частоты дыхательных движений и сатурации гемоглобина в кислороде. Мы наблюдали
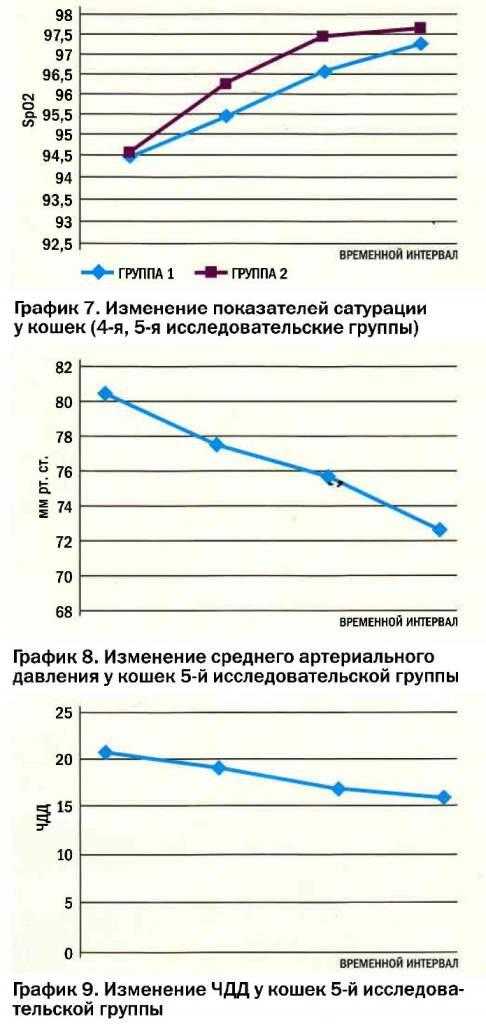
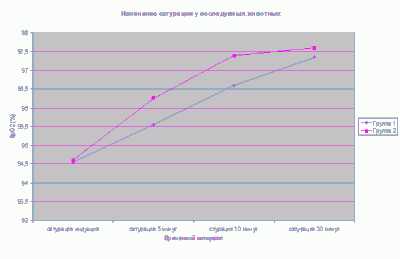
снижение процента кислорода в гемоглобине при вводной анестезии в 4-й и 5-й исследовательских группах (среднее значение до 94,5 %). Во время анестезии этот показатель увеличивался и к 10-й мин. мы регистрировали 96% кислорода, что соответствовало физиологической норме {график 7). При анализе сатурации за весь период наблюдения установлено, что содержание кислорода было выше в 5-й исследовательской группе {в среднем 97,6 %), что свидетельствовало о лучшей оксигенации пациентов. 8 обеих исследовательских группах не отмечено депрессии спонтанного дыхания, анестезия проходила без респираторной поддержки и признаков дыхательной недостаточности. Минимальное значение ЧДД (в среднем 16 ДД/мин) регистрировали у животных 5-й группы, что являлось физиологической нормой для этого вида (график 9).
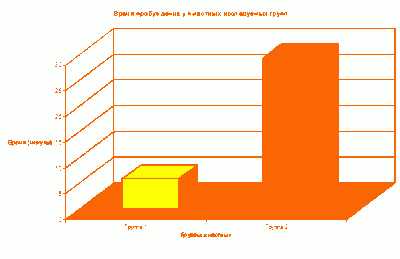
Сознание и двигательная активность быстрее восстанавливались у животных 4-й группы. Это объясняется тем, что им вводили только индукционную дозу препарата пропофол в монорежиме. В среднем, время пробуждения составляло 5 мин. 45 сек. в 4-й группе и 29 мин. 15 сек. в 5-й группе.
Нарушений сердечного ритма, а также судорог, апноэ, цианоз не отмечены у исследуемых групп животных. Также мы не наблюдали клинических симптомов, соответствующих развитию болезни Хайнца.
Обсуждение
Наблюдаемая нами гиперемия слизистых оболочек ротовой полости и глаз, а также гиперемия кожи у трех собак объясняется в большей степени индивидуальной реакцией животных на составляющие ингредиенты пропофола, а именно, содержание соевого компонента, который в отдельных случаях может дать аллергическую реакцию по типу крапивницы. Как правило, такого рода реакция является единственным серьезным проявлением аллергии и не влечет за собой дополнительных последствий.
Опистотонус и «плавательные» движения при применении пропофола, вероятнее всего, происходят по тем же причинам, что и у других предшественников пропофола. Эти непроизвольные движения связаны с возникающей депрессией подкорковых структур, устраняющей ингибирующее влияние на кору. Как правило, данные осложнения возникают при вводной анестезии и являются неэпилептической миоклонией. В некоторых работах показано, что такие состояния у людей и собак не сопровождаются судорожной или эпилептиформной активностью на электроэнцефалограмме (Borgeat A., Wilder-Smith 0HG, 1994). Доказано также, что пропофол вызывает феномены возбуждения (миоклонию, тремор, дистонию) реже, чем этомидат и тиопентал (Reddy R. V., Moorhy S.S., 1993). Миоклония легко снимается применением альфа-2-агонистов, кетамином, золетилом или газовыми анестетиками.
Наблюдаемое снижение ЧСС при комбинации гипнотика пропофола и наркотического анальгетика, является предсказуемым осложнением, исходя из фармакодинамики обоих препаратов. Оба препарата снижают ЧСС, что в совокупности усиливает это действие и может вызвать стойкую брадикардию. Такой же эффект вызывает и комбинация пропофола с ксилазином. Эти изменения гемодинамики являются ожидаемыми и легко компенсируются применением атропина. Повышение ЧСС при использовании пропофола и золетила на начальных этапах индукции, вероятней всего, объясняется компенсаторным процессом, связанным со снижением ЧДД. Также повышение ЧСС при использовании золетила вероятно за счет симпатической стимуляции, которая приводит к синусовой тахикардии.
Артериальная гипотония при применении пропофола в качестве компонента внутривенной анестезии связана со снижением сердечного выброса и снижением сосудистого сопротивления. Этот факт является актуальным у декомпенсированных больных, для которых типична дегидратация и гиповолемия. Однако у исходно здорового животного этот факт может не иметь существенного клинического значения. Индукция анестезии пропофолом в сочетании с фентанилом иногда вызывает артериальную гипотонию, хотя на протяжении всего периода снижения АД на ЭКГ не будет зарегистрировано никаких признаков ишемии миокарда (Наessler R., Madler С, 1992). При индукции, сочетающей пропофол и золетил, возможен незначительный подъем артериального давления вследствие симпатической стимуляции. В случаях отрицательной динамики повышения АД за счет инфузионной терапии, назначаются вазоконстрикторы (допмин, добутамин, адреналин).
Депрессия дыхания при использовании высокодозной пропофоловой анестезии (10 и более мг/кг) будет считаться нормой. Операция может проходить и при спонтанном дыхании, однако обязательным условием будет проведение оксигенотерапии. Именно после перевода животных на искусственную вентиляцию легких (ИВЛ) мы наблюдали повышение показателей сатурации, что являлось объективным критерием респираторной поддержки. В комбинации пропофола и фентанила, а также пропофола и золетила более чем в 70% случаях понадобится респираторная поддержка у собак. При этом, при использовании для индукции шприцевых дозаторов, проведение ИВЛ будет малоинвазивным, что позволит животному сразу же после окончания операции начать дышать самостоятельно. В отношении кошек можно сказать, что эти животные хорошо переносит высокодозную пропофоловую анестезию, которая не проявляется угнетением для дыхательного центра, что дает возможность проведения анестезии при спонтанном дыхании.
Снижение температуры тела наблюдается при использовании всех видов анестезиологического пособия. В некоторых случаях это может оказать свои положительные свойства, например при нейрохирургических вмешательствах. Предрасполагающими факторами к развитию гипотермии являются: длительные хирургические вмешательства на открытых полостях; собаки карликовых пород; операции с массивной кровопотерей. Если же источником гипотермии послужила длительная анестезия, то данное состояние хорошо компенсируется применением электрических одеял и введением теплых растворов.
Выводы
1. Пропофол подходит для использования в качестве средства ОА у кошек и собак, как при кратковременных процедурах, так и при постоянно контролируемой инфузии.
2. Индукционная доза указанного препарата не должна превышать 8 мг/кг МТ.
3. При соблюдении предложенных схем ОА, индукция (в монорежиме 6-8 мг/кг МТ, при сочетании с анальгетиками 4-6 мг/кг МТ) и операция проходят при спонтанном дыхании у кошек, У собак при дозе более 10 мг/кг МТ может возникнуть депрессия дыхания, что потребует респираторной поддержки.
4. В период пробуждения животного возможны эпизоды опистотонуса, 11,4 % случаев, по собственным исследованиям, что самопроизвольно нивелируется через 5-10 мин.
5. Пропофол обладает хорошими реверсивными свойствами, что позволяет минимизировать количество времени пребывания животного в стационаре.
Литература
1. Кирк Р., Бонагура Д. «Современный курс ветеринарной медицины Кирка», М., Аквариум-Принт, 2005.
2. Уиллард М., Тведтен Г., Торнвальд Г. «Лабораторная диагностика в клинике мелких домашних животных», Под ред. д.б.н. В.В. Макарова; М., Аквариум Бук, 2004.
3. Харкевич Д.А. «Фармакология». Гэотар-Мед, 2004.
4. Andress J.L, Day Т.К., Day D. The effects of consecutive day propofol anesthesia on feline red blood cells. Vet Surg, 1995.
5. Bley R., Roos M.,Price J., Ruess-Melzer K., Buchholz J., Poirier V., Kaser-HotzB. Clinical assessment of repeated propofol-associated anesthesia in cats. Journal of the American Veterinary Medical Association, 2007.
6. Boothe D.M. Drug therapy in cats: mechanisms and avoidance of adverse drug reactions. J Am Vet Med Assoc, 1990.
7. Brearley J.C., Kellagher R.E.B., Hall L.W. Propofol Anaesthesia in Cats. Veterinary Anaesthesia and Analgesia, 1988.
8. Glen J.B. Animal Studies of the Anaesthetic Activity of ICI 35 868. British Journal of Anaesthesia, 1980.
9. Liehmann L A comparison of cardiorespiratory variables during isoflurane-fentanyl and propofol-fentanyl anaesthesia for surgery in injured cats. Veterinary Anaesthesia and Analgesia, 2004.
10. Matthews N.S., Brown R.M., Barling K.S., Lovering S.L, Herrig B.W. Repetitive Propofol Administration in Dogs and Cats. Journal of the American Animal Hospital Association, 2004.
11. Mendes G.M., Selmi A.L. Use of a combination of propofol and fentanyl, alfentanil, or sufentanit for total intravenous anesthesia in cats. J Am Vet Med Assoc, 2003.
12. Morgan D.W., Legge K. Clinical evaluation of propofol as an intravenous anaesthetic agent in cats and dogs. Vet Rec, 1989.
13. Pascoe P.J., Ilkiw J.E., Frischmeyer К J. The effect of the duration of propofol administration on recovery from anesthesia in cats. Vet Anaesth Anaig, 2006.
14. Robertson S. What's Different About Anesthetizing Cats? Proceeding of the SEVC Southern European Veterinary Conference, 2008,Barcelona, Spain.
15. Seymour C, Duke T. BSAVA Manual o f Feline and Canine Anaesthesia and Analgesia. 2nd edition. 2007.
журнал VetPharma 1-2011
www.liveanimal.ru
Е.А. Корнюшенков1,2,3, А.И. Гимельфарб1,2,
Клиника экспериментальной терапии НИИ клинической онкологии РОНЦ имени Н.Н. Блохина РАМН, Ветеринарная клиника «Биоконтроль»«Институт развития ветеринарной интенсивной терапии, анестезиологии и реаниматологии – ВИТАР»Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина
Ключевые слова: анестезия, пропован, седация, кошка.
Сокращения: АД ― артериальное давление, ДД/мин ― дыхательные движения в минуту, ОА ― общая анестезия, уд/мин ― удары в минуту, ЧДД ― частота дыхательных движений, ЧСС ― частота сердечных сокращений, SpO2 ― сатурация кислорода в гемоглобине
Общая характеристика пропофола. Пропофол ― внутривенный анестетик короткого действия, используемый как для индукции, так и для поддержания ОА. Относится к фенолам и представляет собой 2,6-диизопропилфенол. Пропофол нерастворим в воде, выпускается в виде 1%-й водно-масляной эмульсии белого цвета, рН нейтральный [1].
Препарат обеспечивает быструю индукцию в анестезию (60…90 с), которая, как правило, не сопровождается выраженной стадией возбуждения. Продолжительность анестезии после однократного болюсного введения составляет в среднем 5…10 мин. В более низких дозах пропофол вызывает седацию. Препарат не обладает анальгетическими свойствами, а лишь повышает порог болевой чувствительности (т.е. уменьшает восприятие боли). Механизм действия пропофола до конца не изучен, однако доказано ингибирование ГАМК-медиаторной трансмиссии. Пропофол не обладает кумулятивными свойствами, поэтому пробуждение даже после длительной инфузии препарата наступает очень быстро как у человека, так и у животных большинства видов. При поступлении в организм пропофол в значительной степени (до 98 %) связывается с белками плазмы крови. Метаболизируется в печени и вне ее. Метаболиты выделяются в основном почками [3].
Данные по применению пропофола у кошек весьма противоречивы. Ряд авторов говорит об успешном применении препарата, как для вводной анестезии, так и для поддержания общей анестезии при процедурах различной длительности [4, 5, 6, 8]. С другой стороны, результаты многих исследований свидетельствуют о продлении периода выхода из анестезии при увеличении времени и кратности введения пропофола у кошек, чего не отмечено у собак [11,12]. Кроме того, по некоторым данным, у кошек отмечается более длительное пробуждение и развитие других негативных эффектов, таких как анемия с образованием телец Хейнца, общее угнетение, анорексия, диарея при применении пропофола в течение нескольких дней подряд [11,12]. У собак, в отличие от кошек, такого явления не наблюдается, и многократное применение пропофола в течение нескольких дней подряд считается безопасным у этого вида животных. Первым опытом применения пропофола у кошек и собак можно считать работу Glen (1980), благодаря которой было показано, что препарат можно эффективно и безопасно применять для общей анестезии у животных этих видов [7].
Активное изучение препарата в ветеринарии мелких домашних животных началось в конце 80-х гг. Первая серьезная работа по изучению действия пропофола у кошек принадлежит Brearley et al. (1988) [6]. В данном исследовании пропофол применяли в качестве индукционного агента у 49 кошек, а также для поддержания общей анестезии у 27 кошек. Авторы отмечают очень мягкое засыпание, отсутствие значительных изменений частоты сердечного ритма, небольшое урежение дыхания. Период пробуждения проходил очень спокойно у всех животных, а его продолжительность у кошек, получавших пропофол на протяжении всего периода анестезии была сравнима со временем пробуждения кошек, которые в качестве поддерживающего агента получали галотан. Побочные эффекты в виде рвоты, чихания и чесания морды наблюдались во время пробуждения у 8 кошек. Mendes & Selmi (2003), исследовали анестезию пропофолом в комбинации с различными опиоидными анальгетиками. После вводной анестезии пропофолом, кошки получали инфузию пропофола или пропофол в комбинации с фентанилом, альфентанилом или суфентанилом в течение 90 мин. [10]. Результаты данного исследования показали, что при использовании пропофола как в монорежиме, так и в комбинации с опиоидами наблюдается минимальное воздействие на гемодинамику, а использование опиоидов позволяет значительно снизить скорость инфузии пропофола. Авторы также отмечают спокойное и легкое пробуждение кошек после каждого из четырех эпизодов анестезии. Исследование Liegmann et al. (2006) показало, что при применении анестезии на основе пропофола с фентанилом у кошек показатели артериального давления остаются более стабильными, по сравнению с ингаляционной анестезией на основе изофлюрана, при которой, как правило, отмечается более выраженная артериальная гипотензия [8]. Morgan & Legge (1989) сообщают об опыте применения пропофола как для индукции, так и для поддержания общей анестезии у 207 кошек [11]. Индукционная доза пропофола у кошек без премедикации составила в среднем 8.03 мг/кг МТ, после премедикации ацепромазином доза пропофола, требуемая для вводной анестезии снижалась приблизительно на 25%. Продолжительность анестезии после однократного введения пропофола без предварительной премедикации составила в среднем от 2,5 до 6 мин. Авторы также отмечают одинаково быстрое и спокойное пробуждение у большинства животных, независимо от кратности и длительности введения пропофола. Однако, при использовании пропофола в качестве поддерживающего агента, число повторных введений не превышало 5 раз.
Результаты другого исследования (Pascoe et al., 2006), напротив, свидетельствуют о значительном продлении времени пробуждения у кошек после длительной инфузии пропофола [12]. В данном исследовании сравнивалась длительность фазы пробуждения при однократном введении пропофола, а также после 30 и 150-минутной инфузии. Время пробуждения кошек после инфузии пропофола в течение 150 минут было значительно дольше и составляло 148 +/- 40 мин. по сравнению с однократным и 30-минутным введением, где время пробуждения составляло 74 и 80 мин., соответственно.
Рекомендуемая доза пропофола для вводной анестезии у кошек без предварительной премедикации составляет 4-8 мг/кг МТ, после премедикации седативными препаратами доза пропофола снижается до 2-6 мг/кг МТ [13]. Поддерживающая доза пропофола по данным того же источника для глубокой седации без интубации трахеи составляет 0,2 мг/кг/мин МТ или 2 мг/кг МТ каждые 5 мин.; для анестезии при выполнении безболезненных процедур в монорежиме 0,4-0,5 мг/кг/мин МТ; для выполнения хирургических операций в комбинации с опиоидными анальгетиками (фентанилом, альфентанилом, суфентанилом) – 0,12-0,3 мг/кг/мин МТ.
Опиоиды и альфа-2-агонисты значительно сокращают потребность в пропофоле. Так, при предварительном введении ксилазина или медетомидина, доза пропофола, требуемая для вводной анестезии может сокращаться в 2-3 раза. Bley, et al. (2007) было показано что мидазолам (0,2 мг/кг МТ) снижает дозу пропофола на 26% [4].
Особенности метаболизма кошек. Большинство липофильных веществ (за исключением ингаляционных анестетиков) подвергается в организме биотрансформации. Важнейшая роль в биотрансформации лекарственных веществ принадлежит микросомальным ферментам печени, благодаря которым липофильные соединения превращаются в гидрофильные и уже после этого экскретируются (как правило, с мочой). Если вещество не подвергается метаболизму, оно может накапливаться и вызывать токсические эффекты[2].
Печеночный метаболизм большинства препаратов состоит из двух фаз ― метаболической трансформации (первая) и конъюгации (вторая). В первую фазу за счет окисления, восстановления и гидролиза вещества становятся более гидрофильными. Во вторую фазу к веществу или его метаболитам присоединяется ряд эндогенных веществ, таких как глюкуронид, глутатион, сульфаты, ацетил и др. Наиболее частой химической реакцией фазы конъюгации является глюкуронизация, которая катализируется ферментами, принадлежащими к семейству глюкуронил-трансфераз.
Было установлено, что у кошек значительно снижена активность некоторых глюкуронил-трансфераз, чем и объясняются особенности действия многих лекарственных средств животных этого вида. В то время как у большинства животных фармакопрепараты быстро экскретируются из организма в виде конъюгатов глюкуроновой кислоты, у кошек клиренс понижен, а период полувыведения препаратов увеличен. Концентрация таких веществ у кошек повышается быстрее, и токсические эффекты более выражены (особенно ярко у этого вида животных проявляется токсичность ацетаминофена, или парацетамола).
Однако, не все экзогенные вещества, метаболизм которых сопряжен с глюкуронизацией, токсичны для кошек. Во-первых, это зависит от того, какая именно глюкуронил-трансфераза требуется для метаболизма того или иного вещества и от выраженности дефицита данного фермента, во-вторых, от широты фармакологического действия вещества, в-третьих, от наличия альтернативных путей метаболизма. У кошек довольно хорошо развит путь конъюгации с сульфатами, который может компенсировать недостаточность глюкуронизации [6].
Пропофол ― фенольное соединение и метаболизируется главным образом в печени с образованием глюкуронидов и сульфатных конъюгатов. Дефицитом глюкуронизации, необходимой для метаболизма фенольных соединений, и объясняется феномен более длительного пробуждения, отмеченный многими исследователями после длительного введения пропофола кошкам.
Анемия с образованием телец Хейнца (Heinz body formation anaemia). Тельца Хейнца представляют собой скопления денатурированного, преципитированного гемоглобина в эритроцитах. Их образование связано с окислительным повреждением эритроцитов, под воздействием активных метаболитов кислорода (О2, Н2О2, ОН—), а также с некоторыми другими механизмами. Окислительное повреждение способствует также переходу гемоглобина в метгемоглобин, который не способен присоединять кислород. В результате описанных процессов способность эритроцитов переносить кислород снижается.
У кошек тельца Хейнца обнаруживаются чаще, чем у животных других видов, что связано с более высокой интенсивностью их образования и более медленным удалением. Гемоглобин кошек содержит до 20 S-H-групп, в то время как у других видов животных и у человека их содержание не превышает 4 [6]. Повышенное содержание сульфгидрильных групп делает гемоглобин кошек более подверженным окислительному повреждению. Еще одним фактором, способствующим быстрому образованию телец Хейнца, считается легкий переход гемоглобина кошек из состояния тетрамера в состояние димера. Замедленное удаление из кровотока эритроцитов, содержащих тельца Хейнца, объясняется особенностями строения селезенки кошек. В норме у здоровых кошек количество эритроцитов, содержащих тельца Хейнца, достигает 1…2 %, хотя и при уровне в 10 % кошки могут выглядеть клинически здоровыми.
К окислительным токсинам, вызывающим образование телец Хайнца у кошек, относятся метиленовый синий, ацетаминофен, фенацетин, пропиленгликоль и др. Пропофол тоже является таким окислителям. Повреждение эритроцитов под действием некоторых перечисленных препаратов объясняется не только особенностями строения гемоглобина кошек, но также более медленным метаболизмом этих веществ. Повышение количества телец Хейнца отмечено при некоторых системных заболеваниях, таких как жировая дистрофия печени, сахарный диабет, гипертиреоидизм и лимфома. Поскольку у кошек метаболизм пропофола в связи с дефицитом глюкуронизации замедлен, время воздействия препарата на эритроциты продлевается, что увеличивает возможность их окислительного повреждения.
Таким образом, согласно литературным данным, пропофол является эффективным и безопасным препаратом для вводной анестезии у кошек, а также может с успехом применяться для поддержания ОА при непродолжительных вмешательствах (до 30 мин.) Информация же о применении пропофола у кошек в качестве поддерживающего анестетика при более длительных вмешательствах весьма противоречива. До сих пор нет единого мнения о допустимости применения данного препарата в течение длительного периода (более 30 мин), а также о безопасности многократных введений его кошкам через короткие интервалы времени.
Исследовать гемодинамические показатели кошек после применения препарата «Пропован» («Бхарат Серумз энд Вакцинз», Индия) при непродолжительных процедурах (лучевая терапия). Установить побочные явления у кошек, связанные с применением данного препарата.
На базе Клиники экспериментальной терапии НИИ клинической онкологии РОНЦ им. Н.Н. Блохина РАМН совместно с Ветеринарной клиникой «Биоконтроль» был апробирован препарат «Пропован», («Бхарат Серумз энд Вакцинз», Индия), действующим веществом которого является пропофол. Исследование проведено на 35 кошках, проходивших плановое лечение в ветеринарной клинике «Биоконтроль». Возраст животных составлял от 4 до 12 лет.
Животных разделили на две группы. Кошкам первой группы (n=20) были назначены непродолжительные лечебные процедуры (лучевая терапия) под ОА препаратом «Пропован». Продолжительность анестезии составляла 10 мин. Оценивали такие параметры, как наличие или отсутствие возбуждения (опистотонуса) при вводной анестезии, ЧСС, SpO2 (с помощью пульсоксиметра фирмы Dixion), время и характер пробуждения животных. В качестве премедикации использовали атропин 0,025 мг/кг МТ в/в и тавегил 0,3 мл/животное в/в, разбавленный физиологическим растворам в пропорции 1:5. Индукционная доза ― 6…8 мг/кг МТ препарата «Пропован» болюсно.
Во вторую группу (n = 15) входили животные, которым было назначено плановое хирургическое вмешательство. Премедикация: атропин 0,05 мг/кг МТ п/к, амоксицилин 12,5 мг/кг МТ п/к, тавегил 0,3 мл/животное в/м, буторфанол 0,4 мг/кг МТ в/м. В качестве компонентов ОА пациентам применяли Пропован в дозе 4…6 мг/кг МТ и Золетил 2 мг/кг МТ. Оценивали такие критерии, как наличие или отсутствие возбуждения у животного при индукции, АД, ЧСС, ЧДД, SpО2 (используя кардиомонитор фирмы Mindrey). Всем животным с целью профилактики гиповолемии проводили инфузионную терапию раствором Рингера со скоростью 10 мл/кг МТ/ч.
При вводной анестезии препаратом «Пропован» мы не наблюдали признаков возбуждения или опистотнуса у исследуемых животных. У 4 животных (по 2 из обеих групп) мы наблюдали признаки опистотонуса после анестезии, которые не сопровождались другими неврологическими расстройствами (судороги, атаксия) и самопроизвольно нивелировались через 5…10 мин.
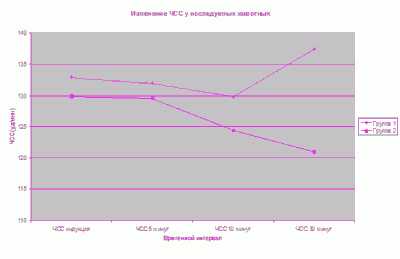
Изменения со стороны сердечно-сосудистой системы регистрировались в двух опытных группах. В первой группе мы наблюдали плавное снижение ЧСС (до 130 уд/мин) по ходу анестезии. В дальнейшем на 10-й мин ЧСС повысилась (до 135 уд/мин), что соответствовало фазе пробуждения животного и являлось физиологической нормой. Во второй группе на всем протяжении анестезии мы наблюдали снижение ЧСС (до 122 уд/мин), что являлось физиологической нормой и не требовало фармакокоррекции. Дополнительным методом контроля сердечно-сосудистой системы у животных второй опытной группы было измерение АД. Мы наблюдали тенденцию к снижению АД (среднее значение) в группе (до 72 мм рт. ст.), что соответствовало норме и не требовало дополнительного введения вазоконстрикторов.
Изменения со стороны дыхательной системы регистрировали по данным частоты дыхательных движений и сатурации гемоглобина в кислороде. Мы наблюдали снижение процента кислорода в гемоглобине при вводной анестезии в двух исследовательских группах (до 94,5 % среднее значение). Во время анестезии этот показатель увеличивался и к 10-й минуте SpO2 составлял 96 %, что соответствовало физиологической норме. При анализе показателя сатурации за весь период наблюдения установлено, что его значения были выше во второй исследовательской группе (в среднем 97,6 %), что свидетельствовало о лучшей оксигенации пациента. В обеих исследовательских группах не отмечено отсутствие спонтанного дыхания, анестезия проходила без респираторной поддержки и признаков депрессии дыхания. Минимальное значение ЧДД (в среднем 16 ДД/мин) регистрировали у животных второй группы, что являлось физиологической нормой для этого вида животных.
Сознание и двигательная активность быстрее восстанавливались у животных первой группы. Это объясняется тем, что им вводили только индукционную дозу препарата «Пропован» в монорежиме. В среднем время пробуждения составляло 5 мин 45 с в первой группе и 29 мин 15 с во второй группе.
Нарушений сердечного ритма, а также судорог, апноэ, цианоз не были отмечены у животных исследуемых групп. Также мы не наблюдали клинических симптомов, соответствующих развитию болезни Хейнца.
Препарат «Пропован» производства компании «Бхарат Серумз энд Вакцинз», Индия подходит для использования в качестве средства ОА у кошек как при кратковременных процедурах, так и в режиме постоянной контролируемой инфузии.
Индукционная доза указанного препарата не должна превышать 8 мг/кг МТ.
При соблюдении предложенных схем ОА, индукция (в монорежиме 6…8 мг/кг МТ, при сочетание с анальгетиками 4…6 мг/кг МТ) и операция проходят при спонтанном дыхании.
В период пробуждения животного возможны эпизоды опистотонуса, 11,4 % случаев по собственным исследованиям, что самопроизвольно нивелируется через 5…10 мин.
Препарат «Пропован», компании «Бхарат Серумз энд Вакцинз», Индия, обладает хорошими реверсивными свойствами, что позволяет минимизировать количество времени пребывания животного в стационаре.
1. Кирк Р., Бонагура Д. Современный курс ветеринарной медицины Кирка ― М.: Аквариум-Принт, 2005.
2. Уиллард М., Тведтен Г., Торнвальд Г. Лабораторная диагностика в клинике мелких домашних животных / Под ред. д.б.н. В.В. Макарова; ― М.: Аквариум Бук, 2004.
3. Харкевич Д.А. Фармакология. ―ГЭОТАР-МЕД, 2004.
4. Andress J.L., Day T.K., Day D. The effects of consecutive day propofol anesthesia on feline red blood cells. // Vet Surg, 1995; 24(3): 277―282.
5. Bley R., Roos M.,Price J., Ruess-Melzer K., Buchholz J., Poirier V., Kaser-Hotz B. Clinical assessment of repeated propofol-associated anesthesia in cats. // Journal of the American Veterinary Medical Association, 2007; 231(9):1347―1353.
6. Boothe D.M. Drug therapy in cats: mechanisms and avoidance of adverse drug reactions. // J Am Vet Med Assoc, 1990; 196 (8): 1297―1305.
7. Brearley J.C., Kellagher R.E.B., Hall L.W. Propofol Anaesthesia in Cats. // Veterinary Anaesthesia and Analgesia, 1988; 15 (1): 134―134.
8. Glen J.B. Animal Studies of the Anaesthetic Activity of ICI 35 868 // British Journal of Anaesthesia, 1980; 52 (8): 731―742.
9. Liehmann L. A comparison of cardiorespiratory variables during isoflurane–fentanyl and propofol–fentanyl anaesthesia for surgery in injured cats //Veterinary Anaesthesia and Analgesia, 2004; 33 (3): 158―168.
10. Matthews N.S., Brown R.M., Barling K.S., Lovering S.L., Herrig B.W. Repetitive Propofol Administration in Dogs and Cats. // Journal of the American Animal Hospital Association, 2004; 40: 255―260.
11. Mendes G.M., Selmi A.L. Use of a combination of propofol and fentanyl, alfentanil, or sufentanil for total intravenous anesthesia in cats. // J Am Vet Med Assoc., 2003; 1; 223(11): 1608―1613.
12. Morgan D.W., Legge K. Clinical evaluation of propofol as an intravenous anaesthetic agent in cats and dogs. // Vet Rec, 1989; 124(2): 31―33
13. Pascoe P.J., Ilkiw J.E., Frischmeyer K.J. The effect of the duration of propofol administration on recovery from anesthesia in cats. // Vet Anaesth Analg, 2006; 33(1): 2―7.
14. Robertson S. What’s Different About Anesthetizing Cats? // Proceeding of the SEVC Southern European Veterinary Conference, Oct. 17―19, 2008 ― Barcelona, Spain.
15. Seymour C., Duke T. BSAVA Manual of Feline and Canine Anaesthesia and Analgesia. 2nd edition. 2007.
www.biovitar.ru
Препарат вводится только внутривенно.
Для уменьшения болевых ощущений при первоначальной инъекции индукционную дозу Пофола непосредственно перед введением можно смешать в пластмассовом шприце с лидокаином 10 мг/мл для инъекций из расчета 1 часть инъекции лидокаина на 20 частей Пофола.
Пофол не содержит антимикробных консервантов и, как любая липидная эмульсия, может служить благоприятной средой для микроорганизмов. Пофол набирается в стерильный шприц или перфузор с соблюдением правил асептики сразу же после вскрытия ампулы или флакона и вводится незамедлительно. Асептические условия должны быть соблюдены как в отношении Пофола, так и в отношении аппаратуры для введения в течение всего периода введения. Лекарственные средства или жидкости, применяемые в сочетании с Пофолом, следует вводить рядом с местом введения Пофола и с использованием той же канюли. Пофол нельзя вводить через микробиологический фильтр.
Пофол 10 мг/мл может вводится как не разведенным, так и разведенным для инфузии. Каждую ампулу или флакон перед инъекцией или разведением следует внимательно осмотреть на предмет выявления отклонений. При обнаружении каких-либо изменений препарат использовать нельзя. Перед использованием слегка встряхнуть. Остатки любых растворов следует уничтожать.
В тех случаях, когда Пофол применяется в неразведенном виде, для обеспечения требуемой скорости инфузии необходимо использовать надлежащее оборудование. Для этой цели вполне пригодны счетчики капель, мерные инфузионные или шприцевые насосы. Использование обычного инфузионного набора не позволяет с достаточной степенью надежности предотвратить случайную передозировку. При определении максимального объема пропофола в бюретке, необходимо учитывать опасность неконтролируемой инфузии. Одновременно с Пропофолом 10 мг/мл разрешается вводить натрия хлорид или раствор декстрозы через Y-образный коннектор.
Пофол 10 мг/мл можно разводить 0,9% раствором хлорида натрия или 5% раствором декстрозы для инфузий. Разводить следует не более чем в 5 раз (минимальное содержание пропофола 2 мг/мл), и использовать с этой целью пакет из ПВХ или стеклянную бутыль для инфузий. Если используется инфузионный пакет из ПВХ, то следует брать полный пакет и готовить раствор, отлив часть инфузионной жидкости и заменив ее равным объемом пропофола. Особое внимание должно уделяться приготовлению раствора в асептических условиях непосредственно перед введением. Любые разведенные растворы должны быть использованы в течение 6 часов после приготовления. Остатки любых растворов необходимо уничтожать.
Разведение Пофола и одновременное применение его в сочетании с другими лекарственными средствами
| Методика одновременного введения препаратов | Вспомогательное вещество или растворитель | Приготовление | Меры предосторожности |
| Предварительное смешивание | 5% раствор декстрозы для внутривенной инфузии | Смешивать 1 часть Пофола 10 мг/мл и 4 части 5% раствора декстрозы для внутривенной инфузии в пакете из ПВХ или стеклянном флаконе. При разведении в мешках из ПВХ, рекомендуется заполнить мешок полностью, заменив эквивалентным объемом Пофола. | Готовить в асептических условиях, непосредственно перед применением. Смесь сохраняет стабильность в течение 6 часов. |
| Раствор лидокаина гидрохлорида для инъекций (0,5% или 1%, без консервантов). | Смешать 20 частей Пофола 10 мг/мл с 1 (или менее) частью 0,5% или 1% раствора лидокаина гидрохлорида для инъекций. | Готовить в асептических условиях, непосредственно перед применением. Применять только для вводного наркоза. | |
| Одновременное введение с помощью Y- образного коннектора | 5% раствор декстрозы для внутривенной инфузии или 0,9% раствора натрия хлорида для внутривенной инфузии. | Одновременное введение осуществлять с помощью Y- образного коннектора. | Поместить Y-образный конектор рядом с местом инъекции. |
Доза Пофола 10 мг/мл индивидуально подбирается опытным анестезиологом в зависимости от веса пациента, чувствительности к пропофолу и другим сопутствующим лекарствам. Пофол также используется для седации при проведении хирургических и диагностических процедур, и имеется опыт его применения в сочетании со спинальной и эпидуральной анестезией. Рекомендуется титровать пропофол в зависимости от реакции пациента вплоть до появления клинических признаков наступления анестезии.
Взрослые
Вводная анестезия
Пофол можно применять для вводной анестезии посредством медленного болюсного введения или инфузии. Дозу препарата, независимо от наличия или отсутствия премедикации, взрослым со средней массой тела, при удовлетворительном общем состоянии следует титровать индивидуально (20-40 мг пропофола каждые 10 секунд) в зависимости от реакции пациента до появления клинических признаков анестезии.
Для большинства пациентов в возрасте до 55 лет и пациентов 1 и 2 степени ASA (American Society of Anesthesiologist) вероятнее всего будет необходимо ввести пропофол в дозе 1,5-2,5 мг/кг массы тела; старше 55 лет и пациентам 3 и 4 степени ASA, особенно при ослабленной сердечной функции, понадобятся меньшие дозировки, и общая доза Пофола 10 мг/мл может быть сокращена до минимальной - 1 мг/кг массы тела. Таким пациентам препарат следует вводить с меньшей скоростью - приблизительно 2 мл (или 20 мг) каждые 10 секунд. Общая доза может быть сокращена при более низкой скорости введения (20-50 мг/мин).
Поддержание общей анестезии
Поддержание необходимой глубины анестезии осуществляется посредством постоянной инфузии или повторяющихся болюсных инъекций Пофола 10 мг/мл.
Постоянная инфузия
Требуемая скорость инфузии у разных пациентов заметно колеблется. Для поддержания общей анестезии следует назначать пропофол в дозе 4-12 мг/кг/ч. Более пожилым, ослабленным пациентам, а также пациентам с гиповолиемией или с ASA 3 и 4 степени, следует сокращать дозу до 4 мг/кг/ч. При наступлении анестезии (приблизительно в течение первых 10-20 минут) некоторым пациентам может быть показана слегка повышенная скорость инфузии (8-10 мг/кг/ч).
Повторяющиеся болюсные инъекции в дозе 25-50 мг (2,5-5,0 мл) в зависимости от реакции пациента. Пожилым пациентам не следует назначать быстрые болюсные инъекции (единичные или повторяющиеся), поскольку это может привести к сердечно-сосудистой недостаточности.
Обеспечение седативного эффекта для пациентов на искусственном дыхании во время интенсивной терапии
Для седации во время интенсивной терапии рекомендуется вводить пропофол путем постоянной инфузии. Скорость инфузии определяется желаемой глубиной седации. У большинства пациентов можно добиться достаточного уровня седации при дозе пропофола 0,3-0,4 мг/кг/ч. Специалистам, назначающим дозу, рекомендуется, по возможности, не превышать дозу в 4 мг/кг/ч (см. "Особые указания"). Продолжительность постоянных инфузий пропофола не должна превышать 7 дней. Для обеспечения седации в отделениях интенсивной терапии не рекомендуется вводить пропофол при помощи систем TCI (Целевая контролируемая инфузия).
Седация при проведении хирургических и диагностических процедур
Дозу следует подбирать индивидуально в зависимости от клинической реакции пациента. Достаточная седация для проведения хирургических и диагностических процедур обычно достигается введением сначала 0,5 - 1 мг/кг/ч в течение 1-5 минут, а затем поддерживается постоянной инфузией при скорости 1,0 - 4,5 мг/кг/ч. Если возникает необходимость получения большего седативного эффекта, то дополнительно можно ввести болюсную дозу пропофола в
10-20 мг. Пациентам с ASA 3 и 4 степени и пациентам пожилого возраста может потребоваться снижение дозы и скорости введения.
Дети
Введение в наркоз
Пофол не назначают детям младше 3 лет.
Для введения в наркоз дозу Пофола 10 мг/мл следует медленно титровать в зависимости от реакции пациента до появления клинических признаков наступления анестезии. Дозу подбирают в зависимости от возраста и/или массы тела. Большинству пациентов старше 8 лет для введения в наркоз вероятнее всего будет достаточно дозы приблизительно в 2,5 мг на кг массы тела Пофола 10 мг/мл. Для детей младше 8 лет дозы могут быть выше (2,5 - 4 мг/кг). Детям с риском анестезии ASA 3 и 4 степени - в меньших дозах.
Поддержание общей анестезии
Анестезия поддерживается благодаря введению Пофола 10 мг/мл посредством постоянной инфузий или повторяющихся болюсных инъекций. Дозировка должна подбираться индивидуально, но для достижения требуемой анестезии достаточная скорость инфузии обычно составляет 9-15 мг/кг/ч.
Седация при интенсивной терапии, хирургических и диагностических процедурах
Пропофол для седации при интенсивной терапии не назначается пациентам в возрасте 16 лет или младше (см. "Противопоказания"),
При использовании пропофола у детей без учета рекомендаций наблюдались случаи развития серьезных побочных эффектов (включая летальные исходы), хотя наличие причинной взаимосвязи между этими явлениями и применением пропофола не было доказано. Побочные эффекты чаще всего встречались у детей с инфекциями дыхательных путей при назначении доз, превышающих рекомендуемые.
www.lsgeotar.ru
Клиника экспериментальной терапии НИИ клинической онкологии РОНЦ имени Н.Н. Блохина РАМН с Ветеринарной клиникой «Биоконтроль» Анестезиологическое ветеринарное общество – ВИТАР Филиал кафедры фармакологии и токсикологии имени И.Е. Мозгова ФГОУ ВПО МГАВМиБ имени К.И. СкрябинаКорнюшенков Е.А.1,2,3, Данилевская Н.В.2,3
В современной практике известно большое количество схем внутривенной анестезии применяемых для общей анестезии, как у людей, так и у животных. В англоязычной литературе такие схемы называют сбалансированной анестезией (balanced anaesthesia – BA) или тотальной внутривенной анестезией (total intravenous anaesthesia — TIVA) [2,6]. Несомненно, эти схемы не являлись «идеальными» и уступали по фармакокинетическим и фармакодинамическим эффектам ингаляционным методом анестезии. Но с появлением в арсенале анестезиологов препаратов ультракороткого действия и систем контроля подачи анестетиков с помощью инфузионных систем, отношение к внутривенной анестезии изменилось. В современной практике удается реализовать концепцию P.Roberts о минимальном уровне инфузии препарата, т.е. о минимальной дозе препарата, способной подавлять двигательную активность у 50% пациентов в ответ на разрез кожи (ED50). Эта величина схожа с широко применяемой константой, характеризующей активность ингаляционных анестетиков – минимальной артериальной концентрацией [8].
Особое место в современной анестезиологии занимает пропофол. Хорошая переносимость животными, минимальное влияние на гемодинамические показатели, небольшая аллергогенность сделали пропофол препаратом выбора во многих областях анестезиологии [4,5]. Кратковременность действия препарата оказалось необходимой при проведении коротких процедур (седация, рентгенография, лучевая терапия, эндоскопия и т.д.) [5,9]. Однако в отечественной литературе не достаточно описано комбинированное использование пропофола с другими компонентами общей анестезии (диссоциативными анестетиками, наркотическими анальгетиками, бензодиазепинами, альфа 2-агонистами), а также влияние различных схем на кардиореспираторные функции.
Работа выполнена на базе Клиники экспериментальной терапии НИИ клинической онкологии РОНЦ имени Н.Н. Блохина РАМН с Ветеринарной клиникой «Биоконтроль» в период с 2006 по 2010 год. Объектом исследования были собаки (n=40) в возрасте от 7 до 11 лет, разных полов, пола, подобранные по принципу пар аналогов, которым в плановом порядке выполнялось оперативное лечение по поводу раку молочной железы.
Для оценки влияния различий схем тотальной внутривенной анестезии на кардиореспираторные показатели, были сформированы 2 основные группы животных (таблица 1).
Таблица 1. Общая схема проведения эксперимента
| Группы | Группа 1 ( n = 20) | Группа 2 контроль ( n = 20) |
| Фармакологические препараты (индукционная доза) | пропофол 6 мг/кг/МТ золетил 4 мг/кг/МТ | диазепам 0.5 мг/кг/МТ кетамин 5 мг/кг/МТ ксилазин 2.5 мг/кг/МТ |
| Фармакологические препараты (поддерживающая доза) | пропофол 12 мг/кг/МТ/ час золетил 6 мг/кг/МТ/ час | кетамин 5 мг/кг/МТ/час ксилазин 2.5 мг/кг/МТ/час |
За 15-20 минут до дачи общей анестезии выполняли премедикацию фармакологическими препаратами по общепринятой методике [3]. Непосредственно перед введением общих анестетиков катетеризировали латеральную подкожную вену голени катетером фирмы HELMFLOT диаметром 12 G. По катетеру вводили внутривенно антигистаминные препараты (димедрол 1% в дозе 10 мг/кг), а также холинолитики (атропина сульфат 0.1% в дозе 0.05 мг/кг), разведенные 1:5 физиологическим раствором натрия хлорида 0.9% [3,5].
После выполнения премедикации всем животным вводили вводный наркоз. Индукцию в наркоз осуществляли вручную струйным введением препаратов. В дальнейшем индукцию проводили используя одноканальный или двухканальный шприцевой насос фирмы Dixon.
1-ая группа животных (n=20) в качестве компонентов вводного наркоза получала пропофол 6 мг/кг/МТ и золетил 4 мг/кг/МТ. Базисная анестезия включала в себя введение пропофола 12 мг/кг/МТ/час и золетила 6 мг/кг/час.
2-ая группе животных (n=20), группа контроля для вводного наркоза получала препараты диазепам (0.5 мг/кг/МТ), ксилазин (2.5 мг/кг/МТ) и кетамин (5 мг/кг/МТ). Базисная анестезия заключалась во введении ксилазина (2.5 мг/кг/МТ/час) и кетамина (5 мг/кг/МТ/час).
Для объективной оценки исследования фармакодинамических эффектов на кардиореспираторные функции при общей анестезии использовали кардиомонитор Sensetec 1200 [7,8,9]. Для изучения влияния схем тотальной внутривенной анестезии на сердечно-сосудистую систему исследовали такие параметры как: АД неинвазивным методом, изменение ЧСС, а также ЭКГ. При исследовании состояния дыхательной системы оценивали ЧДД и показатели сатурации кислорода в гемоглобина с помощью пульсоксиметрии (SpO2), а также возможностью проведения операции при спонтанном дыхании. Показатели мониторинга ЧСС, ЧДД, АД, и SpO2 проводили в четырех временных промежутках: во время вводной индукции; через 5 минут после вводной индукции; через 30 минут после вводной индукции; через 60 минут после индукции. Интрооперационно измерение артериального давления осуществляли неинвазивным (осциллометрическим) методом, используя манжетки трех диаметров. В зависимости от массы тела животного использовали манжетки разного диаметра. При измерении артериального давления получали результаты систолического, диастолического и среднего артериального давления.
Мониторинг ЭКГ обеспечивали для визуализации непрерывной волны электрической активности сердца животного для оценки его текущего физиологического состояния. Электроды фирмы Unomedical присоединяли к поверхности подушечек лап (к двум грудным конечностям и одной тазовой). Запись ЭКГ осуществляли во втором отведение с усилением ЭКГ волны 2 мВ. По данным ЭКГ монитор определял ЧСС [8] .
Мониторинг насыщения кислородом гемоглобина артериальной крови измеряли пульсоксиметром фирмы DIXION Storm 5000 неинвазивным методом. Измерение артериальной сатурации кислорода проводили, используя датчик красного светодиода с длинной волны 660 нм. Фиксировали датчик у собак в область языка, так чтобы внутренняя сторона языка покрывала световое окно [7,9].
Респираторную поддержку проводили используя аппарат искусственной вентиляции легких Startech VM-3020 Neo Graph c компрессорам воздуха Ekom DK50D. Искусственную вентиляцию легких проводили в режиме поддержки давлением (pressure control ventilation – PCV) с контролируемым количеством дыхательных движений (режим Assist Control). Выставляли следующие данные респираторной поддержки: частота дыхательных движений (f = 10-15), положительное давление конца выдоха (Peep 2-5 см.вод.ст.), максимальное давление в дыхательных путях (PCV 18-20 см.вод.ст.), пиковое давление вдоха (Ppeak 15-40 см.вод.ст.), дыхательный объем (Vt = 600-1000 ml), время вдоха (T = 1 сек.), отношение вдоха к выдоху (I:E 1:3) [1,4].
Во время анестезии всем животным проводилась подача кислорода (эндотрахеально) концентратором кислорода Oxygene Rator 10 L, из расчета 100 мл/кг массы тела.
Во время оперативного лечения в качестве средств поддержки гемодинамики и профилактики гиповолемии, животным проводилась стандартная инфузионная терапия (кристаллоидами и коллоидами в соотношение 3:1) используя инфузоматы фирмы Sensitec [3,4].
Статистический анализ результатов исследования осуществляли после изучения формы распределения центральных характеристик исследуемых данных. Оценку различия распределения от распределения Гаусса проводили по критерию согласия Колмогорова-Смирнова. При логнормальном распределение проводили математическое преобразование значений. Рассчитывали среднее значение и его 95 % доверительные границы, ошибку среднего, а также медианы и пределы колебания показателя.
Анализ сравнения наблюдаемых изменений показателя в исследуемых группах проводили параметрическим дисперсионным парных сравнений (парный критерий Стьюдента). Такой подход повышает чувствительность критерия. Рассчитывали точное значение p (различия считали достоверными при p<0,05).
Все вычисления проводили с помощью математических пакетов «Statistica for Windows, Release 11.0» (STARSOFT Inc).
Изменение показателей гемодинамики в ходе анестезии пропофол, золетил (1-ая группа) и кетамин, ксилазин (2-ая группа) представлены в таблице 2. Течение анестезии в обеих экспериментальных группах проявлялось стабильным изменением гемодинамики. Как в 1 (пропофол, золетил), так и во 2 группе (ксилазин, кетамин) отмечалось достоверное снижение ЧДД. Однако в 1 группе (пропофол, золетил) введение индукционной дозы в 85% случаях вызывало апноэ (n=17), чего не происходило в контрольной группе, где в течение всего периода анестезии, операция проходила при спонтанном дыхание. Достоверное увеличение SpO2 отмечали в обеих экспериментальных группах. В 1 группе (пропофол, золетил) через 5 минут после индукции данные SpO2 составляли 96,2±0,4%* что соответствовало физиологической норме (96-98%). Однако, у двух собак 1 группы (пропофол, золетил) оперируемых при спонтанном дыхание показатели SpO2 после индукции составляли 89%, и в течение анестезии не превышали 94%.
После введение индукционной дозы, отмечалось умеренное снижение артериального давления. Более выраженное снижение АД наблюдали при использовании 2 схемы (диазепам, кетамин, ксилазин) на 4,1%, тогда как в 1 группе (пропофол, золетил) снижение произошло на 2,1%. Однако в течение анестезии более значительное снижение АД наблюдалось у собак 1 группы (пропофол, золетил) 14,1%*. Критическое снижение АД, требуемое увеличение волемической нагрузки или введения вазоконстрикторов не регистрировалось нами. Снижение ЧСС также наблюдалось в обеих исследовательских группах по ходу анестезии. Достоверное снижение наблюдалось в 1 группе (пропофол, золетил) на 30,9%* от индукции. У собак 2 группы (кетамин, ксилазин) через 5 минут после индукции наблюдали незначительное увеличение ЧСС на 0,8%, а в дальнейшем снижению на 8,9% от индукции. Критическое снижение ЧСС (ниже 50 уд/мин), требующее введение атропина, наблюдалось по одному случаю в обеих экспериментальных группах.
Таблица 2. Изменение показателей гемодинамики у собак 1 и 2 экспериментальных групп.
| Группы | Изменение ЧСС в течение анестезии % от индукции | Изменение ЧДД в течение анестезии % от индукции | Изменение АД (ср.) в течение анестезии % от индукции | Изменение SpO2 в течение анестезии % от индукции |
| Группа 1 (пропофол, золетил) | Снижение на 30,9%* | Снижение на 34,1%* | Снижение на 14,1%* | Увеличение на 3,5%* |
| Группа 2 (диазепам, ксилазин, кетамин) | Снижение на 8,9% | Снижение на 35,9%* | Снижение на 4,2% | Увеличение на 4,7%* |
р<0,05 — *
р<0,001 — **
р<0,0001 — ***
Как видно из таблицы 2 влияние действия анестетиков на кардиореспираторные показатели более выражено у собак, которым выполнялось анестезиологическое пособие пропофолом и золетилом. Колебания ЧСС и АД менее выраженные как на этапе индукции, так и на этапе поддержания анестезии. Критическое снижение ЧСС возможно при проведении 1 и 2 схемы анестезии. Изменения АД возмжно контролировать осуществляя стандартную поддержку инфузионной терапии на основе кристаллоидов (10 мл/кг/час) [3]. При проведении наркоза по схеме 2 (кетамин, ксилазин) не требуется респираторная поддержка, так как комбинация ксилазин-кетамин, меньше влияет на функцию дыхания [3]. Напротив, комбинация золетил-пропофол приводит к угнетению дыхания и возникновению апноэ (85%), что требует респираторной поддержки в виде принудительной вентиляции [4]. При вводной индуции золетил-пропофол, снижение сатурации наблюдается до 89%,что требует преоксигенации, обязательной интубации и ранней респираторной поддержки.
www.biovitar.ru
| стерилизация кошек | 2000 | ||
| стерилизация кошки на дому | 2200 | ||
| кастрация кота | 1500 | ||
| кастрация кота на дому | 1900 | ||
| стерилизация собак | 2900 | ||
| кастрация собак | 2400 | ||
| лапароскопическая стерилизация кошек | 2300 | ||
| кастрация кобелей | 2400 | ||
| стерилизация собак лапароскопия | 3100 | ||
| перелом хвоста у собаки, лечение | 1000 | ||
| переломы у собак | 1100 | ||
| перелом/вывих у собаки | 1000 | ||
| перелом/вывих у кошки | 1000 | ||
| Прибитые пальцы у собак | 1500 | ||
| Ампутация рудиментарных пальцев у собак | 1000 | ||
| Терапия животных | |||
| Обработка раны, послеоперационных швов | 250-300 | ||
| Снять швы собаке, кошке | 250-300 | ||
| Иньекции подкожные, внутримышечные | 300 | ||
| Иньекции внутривенные по катетеру | 400 | ||
| Зондирование пищевода у собаки | 1400 | ||
| Промывание желудка собаке | 1500 | ||
| Ритуальные услуги для животных - усыпление животных | |||
| усыпление собак | 2400 | ||
| усыпление собак на дому | 2600 | ||
| усыпление кота | 1900 | ||
| усыпление кошек | 1900 | ||
| усыпление кошки на дому | 2200 | ||
| Кремация животных (цена за 1 гол.) | |||
| Кремация домашних животных общая | 1500 | ||
| кремация кота | 1500 | ||
| кремация собаки | 3000 | ||
| индивидуальная кремация животных | 3500 | ||
| вывоз животных на кремацию | 1000 | ||
| Болезни животных и их лечение | |||
| отит у собак (воспаление уха) | 1100 | ||
|
|||
| токсоплазмоз у собак | 1400 | ||
| пироплазмоз у собак лечение | 1300 | ||
| дерматит у собак | 900 | ||
| ринит у собак лечение | 950 | ||
| стоматит у собак | 950 | ||
| ячмень у собаки лечение | 950 | ||
| мочекаменная болезнь у кота | 1800 | ||
| сердечная недостаточность у собак кошек | 1600 | ||
| панлейкопения кошек | 2000 | ||
| токсоплазмоз | 800 | ||
| чумка у собак | 900 | ||
| Стафилоккок у собак | 800 | ||
| пироплазмоз у собак | 2000 | ||
| лишай у кошки, собаки | 800 | ||
| глисты у кошки | 700 | ||
| Услуги ветеринара | |||
| ветеринар для собак | 400 | ||
| ветеринарный врач для кошки | 400 | ||
| вызов ветеринара на дом | 400 | ||
| ветеринар офтальмолог прием | 1200 | ||
| врач ратолог | 1200 | ||
| Врач по черепахам (герпетолог) | 1200 | ||
| лечение хорьков | 1000 | ||
| лечение крыс | 1000 | ||
| лечение грызунов | 1000 | ||
| лечение хомяков | 1000 | ||
| врач по рептилиям | 1500 | ||
| лечение мышей | 1000 | ||
| Родовспоможение животным | |||
| роды у кошки помощь в принятии | 1500 | ||
| осмотр кошки перед родами | 500 | ||
| роды у кошки осложнения, помощь | 800 | ||
| роды у собаки, помощь ветеринара | 1200 | ||
| Вакцинация животных | |||
| вакцинация кошек плановая | 500 | ||
| вакцинация собак плановая | 500 | ||
| вакцинация собак на дому | 700 | ||
| вакцинация щенков | 600 | ||
| вакцинация котят | 500 | ||
| вакцинация против бешенства собак | 1200 | ||
| ветврач на дом для вакцинации | 400 | ||
| Грумминг салон (услуги) | |||
| груминг собак | 1200 | ||
| груминг кошек | 900 | ||
| груминг шпица | 1100 | ||
| мытье, сушка собак | 600 | ||
| стрижка собак модельная | 1500 | ||
| стрижка кошек гигиеническая | 1000 | ||
| удаление колтунов | 600 | ||
| стрижка когтей кошке | 500 | ||
| стрижка когтей собаке | 700 | ||
| вызов ветеринарного врача-грумера на дом | 500 | ||
| Зоогостиница (зооотель) | |||
| передержка собак | 360 | ||
| передержка котов | 260 | ||
| передержка собак (цена при длительном содержании) | 300 | ||
| передержка собак (условия vip) | 800 | ||
| передержка крупных собак | 800 | ||
| Анализы животным | |||
| Анализ крови на пироплазмоз | 1900 | ||
| Анализ на определение эктопаразитов | 900 | ||
| Анализ мочи на кошке/собаке | 450 | ||
| Анализ крови животным общий | 550 | ||
| Диагностика для животных | |||
| Эхокг животным | 2300 | ||
| ЭКГ (электрокардиография) | 2900 | ||
| Цифровая диагностика для животных | 1600 | ||
| УЗИ кошкам (один орган) | 900 | ||
| УЗИ собакам (один орган) | 1800 | ||
| УЗИ животным (вся брюшная полость) | 2600 | ||
| Стоматология животных | |||
| Снятие зубного камня у кошки | 2100 | ||
| Снятие зубного камня у собаки | 2300 | ||
| Удаление зубов кошке | 450 | ||
| Удаление зубов собаке | 630 | ||
xn----7sbbagsduascjuhw3ayk1j.xn--p1ai
Пер. с немецкого
Проведение анестезии.
Пациентов выдерживают на голодной диете в течение 8-12 часов, но воду за 1-2 часа до проведения анестезии дают вволю. Потеря жидкости у старых пациентов обычно больше, чем у молодых животных, вследствие худшей концентрационной способности почечных канальцев.
Премедикация.
Мы применяем три разных схемы премедикации для наших старых пациентов:
1. диазепам в/в (0,1-0,3 мг/кг), затем в одном шприце в/в: кетамин (0,2-0,5 мг/кг) и поламивет (0,2-0,5 мг/кг). Преимущества: нейролептанальгезия в течение 20-40 мин. Концентрацию галотана и изофлурана снижаются по сравнению с другими схемами премедикации.
Недостатки: возможно раздражение ЦНС, вследствие чего во время фазы пробуждения может наблюдаться возбуждение. Эта схема противопоказана эпилептикам. Фаза апное при этом такая же, как и при применении второй схемы.
2. диазепам в/в (0,1-0,3 мг/кг), затем тиопентал в/в (10-20 мг/кг).
Преимущества: такая схема премедикации показана эпилептикам и пациентам с миелограммой(?). ваза пробужждения короче, чем при применении первой схемы.
Недостатки: постиндуктивное апное и брадикардия более выражены, чем при применении других схем. Анестезия барбитуратами противопоказана при гипопротеинемии.
3. пропофол в/в (собака: 10мг/кг, кошка 5мг/кг).
Преимущества: при применении этого анестетика наблюдается большая стабильность сердечно-сосудистой системы с незначительным постиндуктивным апное. Терапевтическая широта больше, чем при других схемах, не наблюдается кумулятивного эффекта при передозировке. Как правило, в фазе пробуждения наблюдается небольшое возбуждение.
Недостатки: действие пропофола весьма кратковременно. Через 1-3 минуты необходиом дополнительное введение анестетика. При проведении основной анестезии ингаляционным способом необходимы высокие концентрации наркотических газов. Преперат дорогой.
Основной наркоз.
1. Галотан: нагрузка на печень при применении галотана выше, чем при применении изофлурана. Поскольку растворимость в крови меньше чем у изофлурана, фаза прилива и отлива длиннее.
2. Изофлуран: для этого препарата необходим специальный испаритель. Изофлуран дороже.
3. Пропофол: доза по действию. Как правило: 0,5-1 мг/кг/мин. Препарат можно применять без риска в течение длительного времени для основного наркоза, поскольку он не обладает кумулятивным эффектом. Фаза пробуждения при этом не удлиняется.
Мониторинг.
Мониторинг в процессе проведения анестезии является важным фактором для успешного ее проведения. С помощью контроля клинических параметров и вспомогательных показаний приборов мы можем полностью контролировать глубину наркоза и все жизненно важные параметры пациента.
В течение последних лет мониторинг в процессе наркоза с помощью приборов в ветеринарной медицине приблизился к гуманной. Несмотря на это контроль клинических параметров наркоза необходимо проводить в процессе:
1. Глубина наркоза контролируется по следующим параметрам:
—рефлекс века и роговицы
—тонус мускулатуры нижней челюсти
—состояние глазного яблока и зрачковый рефлекс.
2. Для определения состояния сердечно сосудистой и дыхательной систем необходимо контролировать следующие клинические параметры:
—частоту и глубину дыхания
—параметры слизистой: СНК и цвет
—качество и частоту пульса.
Стоящий на втором месте мониторинг с помощью приборов ни в коем случае не должен проводится только путем снятия ЭКГ. Поскольку животное в большинстве случаев располагается не так, как это необходимо при снятии ЭКГ, полученные данные будут недостоверными. Так, например, через четыре минуты после начала асистолии на кардиограмме не наблюдалось значительных изменений. Поэтому не следует наблюдение за состоянием сердечно сосудистой системы проводить только путем снятия ЭКГ. Необходимо также использовать дыхательный монитор или пищеводный стетоскоп. Оба прибора относительно дорогостоящие и надежны в применении. Пульсоксиметр и пульсоплетизмография значительно более чувствительны к изменениям в состоянии сердечно-сосудистой системы и обеспечения пациента кислородом. Именно старых пациентов необходимо наблюдать с помощью этих приборов, поскольку у них относительно часто встречаются проблемы с сердечно-сосудистой и дыхательной системой.
Не следует забывать о постоянном контроле температуры в процессе и после анестезии. Для этого хорошо применять электрический термометр с длинным, прикрепленным на конце чувствительным прибором. Речь идет не только о часто встречающейся в ходе наркоза гипотермии, но и о гипертермии вследствие жаркой и душной погоды и обусловленной наркозом и вследствие предрасположенности некоторых собак (гончие).
Для успешного проведения анестезии, прежде всего при рискованных операциях, надо быть готовым к осложнениям, непредвиденным ситуациям в ходе проведения анестезии. Случай "реальной опасности" (угрозы жизни пациента) должен быть отрепетирован операционной бригадой. Каждое мероприятие в экстренном случае должно включать три аспекта: мануальный, медикаментозный и аппаративный. для оказания необходимой помощи должны быть приготовлены шприцы с основными препаратами, применяемыми в экстренных случаях, например, адреналин, лидокаин, бикарбонат натрия и т.д. Минимальный набор приборов должен включать баллон Амбу и отсос. Для оптимального обеспечения необходим дефибрилятор и аппарат ИВЛ.
После анестезии.
В постанестетической фазе пациенту необходимо уделять как минимум столько же внимания, как и в преанестетической и во время проведения анестезии.
Непосредственно по окончании фазы основного наркоза начинается фаза пробуждения, при этом могут встречаться следующие осложнения:
—угнетение дыхания и диспное, вызванное морфиноподобными веществами, скопление слизи в области верхних дыхательных путей вследствие анатомических аномалий как, например, спавшаяся трахея или брахиоцефалия.
—возбуждение вследствие применения кетамина.
—рвота, прежде всего у кошек и при применении ксилазина.
—гипо-, а также гипертермия.
В первые дни после проведения анестезии нередко существующие проблемы, прежде всего с сердечно-сосудистой системой или почечная патология, переходят из субклинической формы в острую. Необходимо разъяснить владельцу все возможные осложнения в постанестетический период и договориться, что он как минимум позвонит в случае ухудшения общего состояния пациента. Если существует опасность для жизни в случае старых пациентов, то они должны оставаться в клинике и находится под постоянным контролем в постанестетический период.
Если старым пациентам необходимо диагностически-терапевтическое вмешательство, которое проводится только под общим наркозом, необходимо тщательно спланировать подготовку, проведение анестезии и постанестетическую фазу.
Подготовка к анестезии.
а) Первый шаг — это определение проблемы и точное клиническое, лабораторное исследование и исследование пациента с помощью приборов. После установления статуса пациента необходимо установить степень анестезиологического риска и необходимости проведения общей анестезии: необходима ли общая анестезия и нельзя ли ее заменить (например, при операции на дистальной части конечности провести ее под региональной анестезией)? При этом не следует забывать о чувствительности пациента: при замещении общей анестезии стресс-факторы (в сочетании с побочными эффектами местной анестезии) могут вызвать больше проблем, чем общая анестезия, это я говорю, исходя из собственного опыта. После этого необходимо обо всем проинформировать владельца.
b) Проводится клиническое исследование всех систем органов, основное внимание следует обратить на следующие органы:
1. Сердечно-сосудистая система: здесь следует исключить часто встречающиеся у собак мелких пород в пожилом возрасте изменения клапанов с вторичными повреждениями миокарда и не редкие у собак крупных пород наджелудочковые дисритмии.
2. Дыхательная система: трахеальный коллапс, хронический бронхит и опухоли в легких — заболевания, встречающиеся преимущественно в пожилом возрасте, которые могут спровоцировать угрожающие жизни ситуации в процессе проведения общей анестезии.
3. Почки: особенно важным для исследования функции почек является тот факт, что почки в процессе наркоза, как правило, незначительно кровоснабжаются. Уровень клубочковой фильтрации снижается, это приводит к повышению концентрации веществ, удаляемых с мочой.
4. Печень: как важнейший орган в метаболизме анестетиков, печень играет решающую роль в фазе подготовки, в процессе проведения анестезии и постоперационной фазе. Следует учитывать часто встречающиеся у старых пациентов липидозы печени, вызываемые часто эндокринными причинами (сахарный диабет, синдром Кушинга, гипотиреоз), цирроз печени, а также опухоли печени.
5. Эндокринная система: следует исключить путем сбора анамнеза и клинического исследования гипотиреоз, гиперадренокортицизм, гипергликемию и гиперинсулинизм. Эти заболевания могут привести к ситуациям, угрожающим жизни пациента в пре- и постоперационной фазе.
Лабораторное исследование должно проводиться как минимум по следующим параметрам:
Лейкоциты, Hb, гематокрит, тромбоциты, ALT, мочевина, глюкоза. При изменениях необходимо установить содержание Nh4 и провести BSP. Для установления состояния мочевыводящих путей проводят полное исследование мочи: химические показатели, SG, осадок и кровь в моче.
При обнаружении патологии сердечно-сосудистой или дыхательной системы проводят рентген грудной клетки, ЭКГ и эхокардиографию.
Необходимо катетеризировать вену при любом наркозе. Через катетер возможно введение жидкостей и препаратов для премедикации и основного наркоза; для предотвращения ситуаций, угрожающих жизни пациента венозный катетер играет решающую роль.
Оригинал статьи расположен по ссылке: http://www.vkb.ru
www.allvet.ru
Pragueratter | Все права защищены © 2018 | Карта сайта